
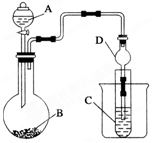
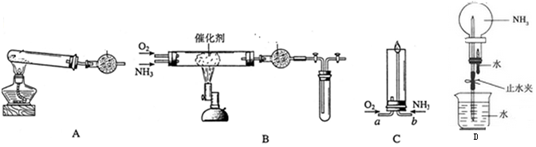
 为探究元素的非金属性的变化规律,某化学兴趣小组同学设计了如下一系列实验,利用如图所示装置:
为探究元素的非金属性的变化规律,某化学兴趣小组同学设计了如下一系列实验,利用如图所示装置:分析 (1)根据仪器的构造写出仪器A的名称;球形干燥管具有防止倒吸的作用;
(2)氯气与硫化钠发生氧化还原反应生成单质硫;氯气将硫离子氧化成单质硫,反应的离子方程式为:Cl2+S2-=2Cl-+S↓;多余的氯气用氢氧化钠溶液吸收;
(3)要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明.
解答 解:(1)仪器A为分液漏斗,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,故答案为:分液漏斗;防止倒吸;(1)分液漏斗;防倒吸
(2)氯气与硫化钠发生氧化还原反应生成单质硫;氯气将硫离子氧化成单质硫,所以观察现象为有淡黄色沉淀生成,反应的离子方程式为:Cl2+S2-=2Cl-+S↓;多余的氯气用氢氧化钠溶液吸收,故答案为:淡黄色沉淀;Cl2+S2-=2Cl-+S↓;NaOH;
(3)若要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明,由于B中加CaCO3,故A中可以加盐酸,通过盐酸和碳酸钙反应来制取CO2,然后的CO2通入C中的Na2SiO3中,可以发生反应:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,产生白色胶状沉淀,从而可以证明酸性:H2CO3>H2SiO3,故非金属性:C>Si,而盐酸是挥发性的酸,所以在B和C之间加装有饱和NaHCO3溶液的洗气装置,除去二氧化碳气体中氯化氢气体,
故答案为:白色沉淀;在B和C之间加装有饱和NaHCO3溶液的洗气装置.
点评 本题考查性质实验方案设计,涉及非金属性强弱的探究,明确物质的性质是解本题关键,知道非金属性强弱判断方法,会根据物质性质设计实验,题目难度中等.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 8种 | C. | 32种 | D. | 64种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C7H16主链上有5个碳原子的同分异构体有5种 | |
| B. | 按系统命名法,化合物的名称是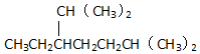 2,6-二甲基-3-乙基庚烷 2,6-二甲基-3-乙基庚烷 | |
| C. | 乙炔分子的球棍模型: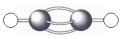 | |
| D. | 卤代烃加入硝酸酸化的硝酸银溶液根据生成的卤化银沉淀颜色检验卤原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质.
现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
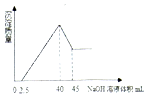 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )| A. | 1mol/L | B. | 2mol/L | C. | 3mol/L | D. | 4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
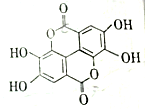 二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )
二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )| A. | 酚 | B. | 醛 | C. | 芳香族化合物 | D. | 羧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4 NA | |
| B. | 标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA | |
| C. | 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| D. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com