
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
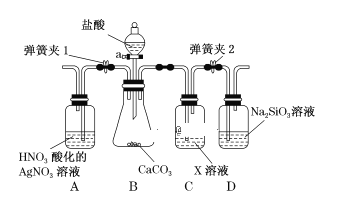
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,…,关闭活塞a。请回答:
(1)B中反应的离子方程式是_________________________________________。
(2)通过步骤 Ⅰ、 Ⅱ 得知盐酸具有的性质是________(填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
(3)C装置的作用是______________,X是____________________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是_______________,D中反应的化学方程式是__________________________________。
(5)碳、硅的非金属性逐渐减弱的原因是_____________________(从原子结构角度加以解释)。
【答案】(1)CaCO3 +2H+=Ca2++ CO2↑+H2O (2)D (3) 除HCl气体 NaHCO3(4)关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后 Na2SiO3 + CO2+H2O= H2SiO3 (胶体) + Na2CO3(5)碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱
【解析】
试题(1)B中是盐酸和CaCO3 反应,离子方程式为:CaCO3 +2H+=Ca2++ CO2↑+H2O。(2)盐酸可以和碳酸钙反应证明有酸性,A中有沉淀生成,说明盐酸进入到A中,则说明盐酸有挥发性,选AD。(3)通过比较碳酸和硅酸的酸性强弱来验证碳和硅两种元素非金属性的相对强弱,利用CO2和Na2SiO3反应来比较碳酸酸性和硅酸的酸性强弱,制取的CO2中混有挥发出来的HCl, 故C装置的作用是除去HCl,可以用NaHCO3溶于吸收HCl。(4)步骤Ⅱ中的操作和现象是:关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后;化学方程式为:Na2SiO3 + CO2+H2O= H2SiO3 (胶体) + Na2CO3。(5)碳、硅的非金属性逐渐减弱的原因是碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱


科目:高中化学 来源: 题型:
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用。请回答下列问題:
(1)区分晶体硼和无定形硼最可靠的科学方法为_________________。
(2)NaBH4是一种重要的储氢载体,阴离子结构式为______________。
(3)图1表示多硼酸根的一种无限长的链式结构,其化学式可表示为________________(以n表示硼原子的个数)。
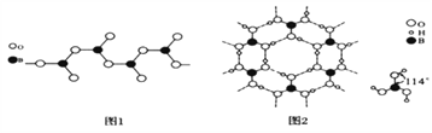
(4)硼酸晶体是片层结构,有与石墨相似的层状结构,图2表示的是其中一层的结构。硼酸晶体中存在的作用力有共价键、________、________。与H3BO3酸性最接近的是________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是____________________。
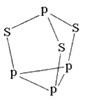
(5)三硫化四磷分子(如图)是_________分子(填“极性”或非极性),用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,某烃的密度是1.25g·L-1,一定体积的该烃完全燃烧生成4.48LCO2和3.6g水,该烃的分子式_________________。
(2)有机物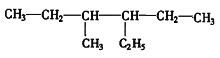 的正确命名为_______________________。
的正确命名为_______________________。
(3)某烃lmol与2molHCl完全加成,生成的氯代烷烃最多还可以与6mol氯气反应,则该烃的结构简式为_______________________。
(4)有下列五种烃:
① ②
②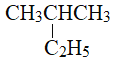 ③乙烷
③乙烷
④正戊烷 ⑤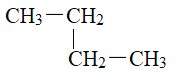 ⑥
⑥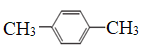
其中互为同分异构体的是__________________(填序号),②③④⑤四种物质按它们的沸点由低到高的顺序是_______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由少到多的顺序为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成细胞的化合物的叙述,正确的是( )
A. DNA是生物体各项生命活动的主要承担者
B. RNA由四种核苷酸组成,可以作为遗传物质
C. 组成淀粉、糖原、纤维素的单体都是葡萄糖
D. 肽链的盘曲和折叠被解开时,其特定功能并未发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关“电离平衡”的叙述中正确的是( )
A. 电解质在溶液里达到电离平衡时,溶质电离出的离子浓度相等
B. 电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡
C. 电离平衡是相对的.暂时的,外界条件改变时,平衡就会发生移动
D. 电解质达到电离平衡后,分子的浓度和离子的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为___________;五种元素的原子半径从大到小的顺序是_______________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为______,B的化学式为____________,Z、X两种元素形成的一种既含离子键又含共价键的物质名称为:____________;
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物与足量烧碱溶液反应的化学方程式为____________。1mol铁跟足量的硒单质化合时,转移的电子数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. 0.1 mol N2的质量是2.8 g
B. Mg的摩尔质量是24 g/mol
C. 2 L 0.1mol·L-1NaCl溶液中,c(Na+)=0.2mol·L-1
D. 标准状况下,11.2 L O2含有的原子数目约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A. 光导纤维是以二氧化硅为主要原料制成的
B. 二氧化硅溶于水生成硅酸
C. 石英、水晶的主要成分都是二氧化硅
D. 二氧化硅是一种熔沸点很高、硬度很大的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种不同物质之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是 ( )
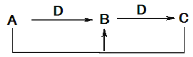
选项 | 假设 | 结论 |
A | A为NaOH溶液 | D可能是CO2 |
B | B为CO | C可能是CO2 |
C | C为FeCl2 ,D为Fe | A可能是盐酸 |
D | C为SO2 | A可能是H2S |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com