
| A. | 16g O2和O3的混合气体中含有的原子数为NA | |
| B. | 在1L0.1 mol/L碳酸钠溶液中,CO32-总数为0.1 NA | |
| C. | 标准状况下,22.4 LSO3与水反应生成1mol硫酸 | |
| D. | 标准状况下,22.4L Cl2完全发生氧化还原反应一定转移2NA个电子 |
分析 A、氧气和臭氧均由氧原子构成;
B、碳酸根为弱酸根,在溶液中会水解;
C、标况下三氧化硫为固体;
D、氯气发生氧化还原反应后的价态不明确.
解答 解:A、氧气和臭氧均由氧原子构成,故16g氧气和臭氧的混合气体中含有的氧原子的物质的量为1mol,故含NA个,故A正确;
B、碳酸根为弱酸根,在溶液中会水解,故溶液中的碳酸根的个数小于0.1NA个,故B错误;
C、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、氯气发生氧化还原反应后的价态不明确,故1mol氯气反应后转移的电子数无法确定,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋白溶胶中加入饱和硫酸铵溶液后有蛋白质析出 | |
| B. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| C. | 因为液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| D. | 电泳现象可证明胶体属于电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制氧气时,用Na2O2或H2O2做反应物可选择相同的气体发生装置 | |
| B. | 制氯气时,用饱和NaHCO3和浓硫酸净化气体 | |
| C. | 制氨气时,用排水法或向上排空气法收集气体 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 使用催化剂 | C. | 降低温度 | D. | 缩小容器体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A2)=0.8 mol•L-1•s-1 | B. | v(A2)=40 mol•L-1•min-1 | ||
| C. | v(AB3)=1.0 mol•L-1•s-1 | D. | v(B2)=1.2 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
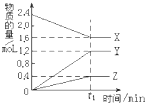 I.某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
I.某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示: 3Y+Z.
3Y+Z.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com