
| A. | 加少量CH3COONa固体 | B. | 加水 | ||
| C. | 加少量CuSO4固体 | D. | 加等量等浓度Na2SO4溶液 |
科目:高中化学 来源: 题型:多选题
| A. | 纯净物 | B. | 混合物 | C. | 化合物 | D. | 单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3的摩尔质量为106 g | |
| B. | 金刚石与石墨互为同位素 | |
| C. | 常温下,4.6gNa中含有的质子数为2.2NA | |
| D. | 标准状况下,11.2LCO2完全参与反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+O2(g)$?_{500℃}^{V_{2}O_{5}}$2SO3(g)△H=-196.6kJ/mol,若2molSO2完全反应则放出热量等于196.6kJ | |
| B. | “冰,水为之,而寒于水”说明相同质量的水和冰比较,冰的能量高 | |
| C. | 已知C(石墨)=C(金刚石)△H=+1.9kJ/mol,则从能量角度看金刚石比石墨稳定 | |
| D. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下,甲酸的导电性比强酸溶液的导电性弱 | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
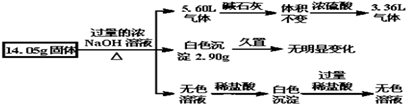
| A. | 一定含有Al,其物质的量为$\frac{5}{3}$mol | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有(NH4)2SO4和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁.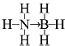 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞. ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成淡黄色沉淀 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不填 | |
| C | 不填 | |
| D | 不填 | |
| E |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com