
【题目】乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为____
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(1) △H1=-890.3kJ/mol
C2H2(g)+2.50(g)===2CO2(g)+H2O(1) △H2=-1299.6J/mol
2H2(g)+O2(g)=2H2O(1) △H3=-571.6kJ/mol
则甲烷气相裂解反应:2CH4(g)===C2H2(g)+3H2(g)的△H=_____kJ/mol。
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
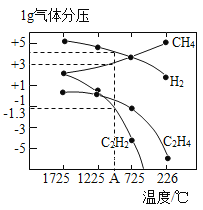
①T1℃时,向1L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有___________。
【答案】CaC2+2H2O→Ca(OH)2+C2H2↑ +376.4kJ/mol > 66.7% > 5 5×104 可以充入适量的乙烯
【解析】
(1)碳化钙和水反应生成氢氧化钙和乙炔;
(2)根据盖斯定律来分析;
(3)①分解反应绝大多数为吸热反应;设出CH4的转化浓度,然后根据三段式,利用c(C2H4)=c(CH4)来解答;根据改变温度后,CH4的浓度升高来判断温度的变化;表示出变化后的CH4和C2H4的浓度,然后根据c(CH4)=2c(C2H4)来计算;
②根据平衡常数表达式来计算;
③甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,可以充入适量的乙烯。
(1)碳化钙和水反应生成氢氧化钙和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)将已知反应依次编号为①、②、③,由盖斯定律将①×4-②-③×![]() 可得:2CH4(g)=C2H2(g)+3H2(g),则△H=(-890.3kJmol-1)×4-(-1299.6kJmol-1)-(-571.6kJmol-1)×
可得:2CH4(g)=C2H2(g)+3H2(g),则△H=(-890.3kJmol-1)×4-(-1299.6kJmol-1)-(-571.6kJmol-1)×![]() =+376.4kJ/mol,故答案为:+376.4kJ/mol;
=+376.4kJ/mol,故答案为:+376.4kJ/mol;
(3)①升高温度,平衡向吸热反应方向移动,由图可知,温度升高,C2H4的平衡分压增大,说明反应2CH4(g)![]() C2H4(g)+2H2(g)向正反应方向移动,则该反应为吸热反应;设平衡时C2H4的平衡浓度为Xmol,由题给数据建立如下三段式:
C2H4(g)+2H2(g)向正反应方向移动,则该反应为吸热反应;设平衡时C2H4的平衡浓度为Xmol,由题给数据建立如下三段式:
2CH4(g)![]() C2H4(g)+2H2(g)
C2H4(g)+2H2(g)
起(mol/L)0.3 0 0
变(mol/L)2X X 2X
平(mol/L)0.3—2X X 2X
由c(C2H4)=c(CH4)可得0.3—2X=X,解得X=0.1mol,CH4的平衡转化率=![]() ×100%=66.7%;改变温度后,CH4的浓度升高,说明平衡向正反应方向移动,则温度应为降低,即T1>T2;由于CH4以0.01mol/(Ls)的平均速率增多,经ts后再次达到平衡,故在ts的时间内,CH4的浓度变化为0.01tmol/L,利用三段式来计算:
×100%=66.7%;改变温度后,CH4的浓度升高,说明平衡向正反应方向移动,则温度应为降低,即T1>T2;由于CH4以0.01mol/(Ls)的平均速率增多,经ts后再次达到平衡,故在ts的时间内,CH4的浓度变化为0.01tmol/L,利用三段式来计算:
2CH4(g)![]() C2H4(g)+2H2(g)
C2H4(g)+2H2(g)
起(mol/L)0.1 0.1 0.2
变(mol/L)0.01t 0.005t 0.01t
平(mol/L)0.1+0.01t 0.1—0.005t 0.2—0.01t
由c(CH4)=2c(C2H4)可得0.1+0.01t=2×(0.1-0.005t),解得t=5S,故答案为:>;66.7%;>;5;
②由图中数据可知,A点温度时,C2H2平衡分压为0.05 Pa,H2平衡分压为104Pa,CH4平衡分压为103Pa,则平衡常数K=![]() =5×104 Pa,故答案为:5×104;
=5×104 Pa,故答案为:5×104;
③甲烷裂解制乙炔有副产物乙烯生成,充入适量的乙烯,可抑制甲烷向乙烯的转化,从而提高甲烷制乙炔的转化率,故答案为:可以充入适量的乙烯。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
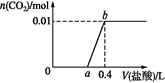
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的恒容密闭容器中充入1 mol CO2(g)和3.5 mol H2(g),在一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。反应进行8 min时达到平衡状态,测得n(CH3OH)=0.5mol。该反应的平衡常数K与温度T的关系如图1所示,CO2的转化率如图2所示,下列说法错误的是
CH3OH(g)+H2O(g) ΔH<0。反应进行8 min时达到平衡状态,测得n(CH3OH)=0.5mol。该反应的平衡常数K与温度T的关系如图1所示,CO2的转化率如图2所示,下列说法错误的是

A. 在图1中,曲线Ⅱ表示该反应的平衡常数K与温度T的关系
B. 该温度下,平衡常数K=0.25
C. 其他条件不变下,图2中x可表示温度或压强或投料比c(CO2)/c(H2)
D. 用二氧化碳合成甲醇体现了碳减排理念
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol·L-1 NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A.当pH=9时,溶液中存在下列关系:c(NH4+)>c(NH3·H2O)>c(HCO3-)>c(CO32-)
B.将0.2 mol CO2通入1 L 0.3 mol·L-1 NH3·H2O溶液中充分反应,则有:c(HCO3-)+3c(H2CO3)-c(CO32-)>0
C.向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D.分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知甲醇分解反应:CH3OH(g)![]() CO(g)+2H2(g) △H1=+90.64 kJ·mol-1;
CO(g)+2H2(g) △H1=+90.64 kJ·mol-1;
水蒸气变换反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.20 kJ·mol-1。
CO2(g)+H2(g) △H2=-41.20 kJ·mol-1。
则CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H3=___________kJ·mol-1。
CO2(g)+3H2(g) △H3=___________kJ·mol-1。
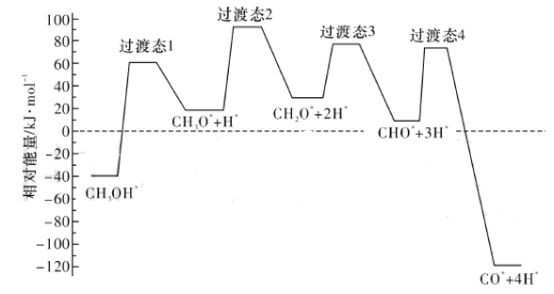
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(III)表面发生解离时四个路径与相对能量的关系如图所示,其中附在Pd(III)表面的物种用*标注。此历程中活化能最小的反应方程式为_____________________________________________。
(3)在0.1MPa下,将总进料量为1 mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
①实验测得水蒸气变换反应的速率随温度的升高明显下降,原因是____________________。
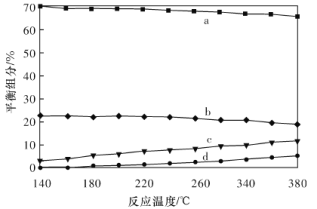
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分的含量与反应温度的关系如图所示,曲线b、c对应物质的化学式分别为________、________。
(4)573.2K时,向一刚性密闭容器中充入5.00 MPa CH3OH使其分解,t h后达平衡时H2的物质的量分数为60%,则t h内v(CH3OH)=_____MPa·h-1,其分压平衡常数Kp=_____MPa2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香 味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
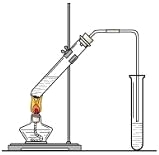
(1)写出制取乙酸乙酯的化学反应方程式
____________________________________________
(2)饱和碳酸钠溶液的主要作用是________、___________、___________________。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是__________。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答:

(1)写出醋酸的电离方程式___________________________________________。
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
(3)a、b、c三点中醋酸的电离程度最大的是_________。
(4)取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:c(H+)甲_____ 10c(H+)乙(填“大于”、“小于”或 “等于”)
(5)醋酸与氨水反应的离子方程式:__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子式为C4H8O3的有机物,在浓硫酸加热的条件下,具有如下性质:①能分别与CH3CH2OH或CH3COOH反应生成酯;②能脱水生成一种使溴水褪色的物质,且该物质的存在形式不只一种。则关于该物质的说法正确的是
A. 该物质不溶于水B. 该物质能发生缩聚反应,生成![]()
C. 该物质能生成四元环状化合物D. 两分子该物质能形成六元环酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是
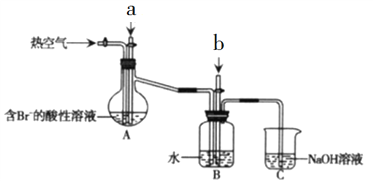
A. A装置中通入的a气体是Cl2
B. 实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气
C. B装置中通入b气体后发生的反应为SO2+Br2+2H2O===H2SO4+2HBr
D. C装置的作用只是吸收多余的SO2气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com