使含有a molAl3+的A溶液中的铝元素和含有b molAlO2-的B溶液中的铝元素全部转化为Al(OH)3沉淀,通过计算讨论有几种途径.写出相应的离子方程式.
要求:
(1)不准另加固体和液体试剂;
(2)应答出每种途径所需试剂和所需试剂的物质的量.若使C mol单质Al全部转化为Al(OH)3沉淀且使用原料最少,应该如何进行操作?写出相应的离子方程式.
【答案】
分析:(1)使铝离子生成氢氧化铝沉淀的方法是:铝离子和弱碱反应生成氢氧化铝沉淀,注意铝离子和强碱反应先生成沉淀,沉淀和氢氧化铝继续反应生成偏铝酸盐;使偏铝酸根离子生成氢氧化铝沉淀的方法是:偏铝酸根离子和二氧化碳或二氧化硫或盐酸反应生成氢氧化铝沉淀;还可以让铝离子和偏铝酸根离子反应生成氢氧化铝沉淀.
(2)若使C mol单质Al全部转化为Al(OH)
3沉淀且使用原料最少的方法是:四分之一的铝生成铝离子,四分之三的铝生成偏铝酸根离子,然后两溶液混合即可.
解答:(1)应向A溶液中通入3a molNH
3,离子方程式为Al
3++3NH
3+3H
2O=Al(OH)
3↓+3NH
4+或
Al
3++3NH
3?H
2O=Al(OH)
3↓+3NH
4+;
应向B溶液中通入

molCO
2或
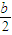
molSO
2或bmolHCl、HBr、HI等,离子方程式为2AlO
2-+CO
2+3H
2O=2Al(OH)
3↓+CO
32-或
2AlO
2-+SO
2+3H
2O=2Al(OH)
3↓+SO
32-或AlO
2-+H
++H
2O=Al(OH)
3↓;
将两种溶液混合,①、若b=3a 则全部生成Al(OH)
3沉淀,离子方程式为:Al
3++3AlO
2-+6 H
2O=4 Al(OH)
3↓
②、若b>3a则再向混合后的溶液中通入

molCO
2或

molSO
2或(b-3a)molHCl、HBr、HI等,离子方程式为
2AlO
2-+CO
2+3H
2O=2Al(OH)
3↓+CO
32-或2AlO
2-+SO
2+3H
2O=2Al(OH)
3↓+SO
32-或AlO
2-+H
++H
2O=Al(OH)
3↓;
③、若b<3a则再向混合后的溶液中通入
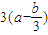
mol NH
3即(3a-b)mol NH
3,离子方程式Al
3++3NH
3+3H
2O=Al(OH)
3↓+
3NH
4+.
答:有两种方法,一种是向A溶液中加氨水使铝离子生成氢氧化铝,向B溶液中通入气体或加酸使偏铝酸根离子生成氢氧化铝沉淀;另一种方法是将两种溶液混合,分三种情况:①恰好反应;②铝离子过量,向混合溶液中加氨水,使多余的铝离子生成氢氧化铝;③偏铝酸根离子过量,向混合溶液中通入气体或加酸.
反应方程式为:Al
3++3NH
3+3H
2O=Al(OH)
3↓+3NH
4+或Al
3++3NH
3?H
2O=Al(OH)
3↓+3NH
4+;
2AlO
2-+CO
2+3H
2O=2Al(OH)
3↓+CO
32-或2AlO
2-+SO
2+3H
2O=2Al(OH)
3↓+SO
32-或AlO
2-+H
++H
2O=Al(OH)
3↓;
(2)若使C mol单质Al全部转化为Al(OH)
3沉淀且使用原料最少,应将

C mol Al与强酸反应转化为Al
3+,另外

C mol Al与强碱反应转化为AlO
2-,然后将两溶液混合,此时所用原料最少,C mol单质A l才能全部转化为Al(OH)
3沉淀.
离子方程式为:2Al+6H
+=2Al
3++3H
2↑;2Al+2OH
-+2H
2O=2 AlO
2-+3H
2↑;Al
3++3AlO
2-+6 H
2O=4 Al(OH)
3↓.
答:将

C mol Al与强酸反应转化为Al
3+,另外

C mol Al与强碱反应转化为AlO
2-,然后将两溶液混合;2Al+6H
+=2Al
3++3H
2↑;2Al+2OH
-+2H
2O=2 AlO
2-+3H
2↑;Al
3++3AlO
2-+6 H
2O=4 Al(OH)
3↓.
点评:本题考查了铝及其化合物的性质,难度较大,注意实验室制取氢氧化铝沉淀用铝盐和氨水反应制取,不用铝盐和强碱反应制取,因为氢氧化铝能溶于强碱,和弱碱不反应.

 molCO2或
molCO2或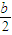 molSO2或bmolHCl、HBr、HI等,离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-或
molSO2或bmolHCl、HBr、HI等,离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-或 molCO2或
molCO2或 molSO2或(b-3a)molHCl、HBr、HI等,离子方程式为
molSO2或(b-3a)molHCl、HBr、HI等,离子方程式为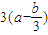 mol NH3即(3a-b)mol NH3,离子方程式Al3++3NH3+3H2O=Al(OH)3↓+
mol NH3即(3a-b)mol NH3,离子方程式Al3++3NH3+3H2O=Al(OH)3↓+ C mol Al与强酸反应转化为Al3+,另外
C mol Al与强酸反应转化为Al3+,另外 C mol Al与强碱反应转化为AlO2-,然后将两溶液混合,此时所用原料最少,C mol单质A l才能全部转化为Al(OH)3沉淀.
C mol Al与强碱反应转化为AlO2-,然后将两溶液混合,此时所用原料最少,C mol单质A l才能全部转化为Al(OH)3沉淀. C mol Al与强酸反应转化为Al3+,另外
C mol Al与强酸反应转化为Al3+,另外 C mol Al与强碱反应转化为AlO2-,然后将两溶液混合;2Al+6H+=2Al3++3H2↑;2Al+2OH-+2H2O=2 AlO2-+3H2↑;Al3++3AlO2-+6 H2O=4 Al(OH)3↓.
C mol Al与强碱反应转化为AlO2-,然后将两溶液混合;2Al+6H+=2Al3++3H2↑;2Al+2OH-+2H2O=2 AlO2-+3H2↑;Al3++3AlO2-+6 H2O=4 Al(OH)3↓.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案