
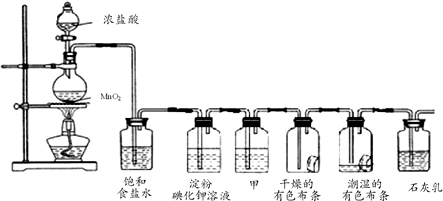
·ÖĪö ·¢Éś×°ÖĆÖŠĶعż¶žŃõ»ÆĆĢŗĶÅØŃĪĖį¼ÓČČ·“Ӧɜ³É£¬ĀČĘųÖŠŗ¬ĀČ»ÆĒāŗćČŻĖ®ÕōĘų£¬Ķعż±„ŗĶŹ³ŃĪĖ®³żČ„ĀČ»ÆĒā£¬Ķعżµķ·Ūµā»Æ¼ŲČÜŅŗ±äĄ¶£¬Ķعż¼×Ļ“ĘųĘæÖŠµÄÅØĮņĖįøÉŌļĀČĘų£¬ĶعżøÉŌļµÄÓŠÉ«²¼Ģõ²»±ä»Æ£¬ĶعżŹŖČóµÄÓŠÉ«²¼Ģõ»įĶŹÉ«£¬×īŗóĶعżŹÆ»ŅČ鷓Ӧɜ³ÉĘÆ°×·Ū£¬
£Ø1£©ÅØŃĪĖįŗĶ¶žŃõ»ÆĆĢ¼ÓČČ·“Ӧɜ³ÉĀČ»ÆĆĢ”¢ĀČĘųŗĶĖ®£¬ÖʱøµÄĀČĘųÖŠŗ¬ĀČ»ÆĒāĘųĢåŗĶĖ®ÕōĘų£¬Ķعż±„ŗĶŹ³ŃĪĖ®æÉŅŌ³żČ„ĀČ»ÆĒāĘųĢ壻
£Ø2£©ĀČĘųŃõ»ÆŠŌĒæÓŚµā£¬Äܹ»Óėµā»Æ¼Ų·“Ó¦ÖĆ»»µā£¬µāÓöµ½µķ·Ū±äĄ¶£»
£Ø3£©ĀČĘųÖŠŗ¬ÓŠĖ®ÕōĘų£¬ŅŖµĆµ½øÉŌļµÄĀČĘų£¬Ó¦Ń”ŌńŗĻŹŹµÄøÉŌļ¼Į£»
£Ø4£©C12ÓėŹÆ»ŅČ鷓Ӧɜ³É“ĪĀČĖįøĘ”¢ĀČ»ÆøĘŗĶĖ®£¬ĘÆ°×·Ū³É·ÖĪŖĀČ»ÆøĘŗĶ“ĪĀČĖįøĘ£¬ÓŠŠ§³É·ÖĪŖ“ĪĀČĖįøĘ£»
£Ø5£©øł¾Ż·“Ó¦MnO2+4HCl£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+Cl2”ü+2H2OæÉÖŖ£¬87gMnO2ĶźČ«·“Ӧɜ³ÉĀČĘų1mol£¬ĖłŅŌ8.7g MnO2Óė×ćĮæµÄÅØŃĪĖįÉś³ÉĀČĘųµÄĪļÖŹµÄĮæŹĒ1mol£¬¾Ż“Ė½ā“š£®
½ā“š ½ā£ŗ£Ø1£©ÅØŃĪĖįŗĶ¶žŃõ»ÆĆĢ¼ÓČČ·“Ӧɜ³ÉĀČ»ÆĆĢ”¢ĀČĘųŗĶĖ®£¬ÖʱøµÄĀČĘųÖŠŗ¬ĀČ»ÆĒāĘųĢåŗĶĖ®ÕōĘų£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗMnO2+4HCl$\frac{\underline{\;\;”÷\;\;}}{\;}$MCl2+Cl2”ü+2H2O£¬Ķعż±„ŗĶŹ³ŃĪĖ®æÉŅŌ³żČ„ĀČ»ÆĒāĘųĢ壬Ķعż±„ŗĶŹ³ŃĪĖ®æÉŅŌ³żČ„ĀČ»ÆĒāĘųĢ壬
¹Ź“š°øĪŖ£ŗMnO2+4HCl£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+Cl2”ü+2H2O£¬³żČ„ĀČĘųÖŠµÄHCl£»
£Ø2£©ĀČĘųŃõ»ÆŠŌĒæÓŚµā£¬Äܹ»Óėµā»Æ¼Ų·“Ó¦ÖĆ»»µā£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCl2+2I-=2Cl-+I2£¬µāÓöµ½µķ·Ū±äĄ¶£¬
¹Ź“š°øĪŖ£ŗČÜŅŗ±äĄ¶É«£¬Cl2+2I-=2Cl-+I2£»
£Ø3£©ÅØĮņĖį¾ßÓŠĪüĖ®ŠŌ£¬Äܹ»ĪüŹÕĀČĘųÖŠµÄĖ®£¬æÉŅŌøÉŌļĀČĘų£¬
¹Ź“š°øĪŖ£ŗÅØĮņĖį£»
£Ø4£©C12ÓėŹÆ»ŅČ鷓Ӧɜ³É“ĪĀČĖįøĘ”¢ĀČ»ÆøĘŗĶĖ®£¬»Æѧ·½³ĢŹ½ĪŖ£ŗ2Cl2+2Ca£ØOH£©2=CaCl2+Ca£ØClO£©2+2H2O£¬ĘÆ°×·ŪµÄÓŠŠ§³É·ÖŹĒ“ĪĀČĖįøĘ£¬
¹Ź“š°øĪŖ£ŗ2Cl2+2Ca£ØOH£©2=CaCl2+Ca£ØClO£©2+2H2O£¬Ca£ØClO£©2£»
£Ø5£©øł¾Ż·“Ó¦MnO2+4HCl£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+Cl2”ü+2H2OæÉÖŖ£¬ĄķĀŪÉĻ87gMnO2ĶźČ«·“Ӧɜ³ÉĀČĘų1mol£¬ĖłŅŌ8.7g MnO2Óė×ćĮæµÄÅØŃĪĖįÉś³ÉĀČĘųµÄĪļÖŹµÄĮæŹĒ0.1mol£¬±źæöĻĀĘųĢåĢå»żĪŖ£ŗ0.1mol”Į22.4L/mol=2.24L£¬
¹Ź“š°øĪŖ£ŗ2.24£®
µćĘĄ ±¾Ģāæ¼²éĮĖĀČĘųµÄŹµŃéŹŅÖĘ·ØŗĶĀČĘųµÄŠŌÖŹ£¬ŹģĻ¤ÖʱøŌĄķŗĶĀČĘųµÄŠŌÖŹŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®


 Ńō¹āæĪĢĆĶ¬²½Į·Ļ°ĻµĮŠ“š°ø
Ńō¹āæĪĢĆĶ¬²½Į·Ļ°ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Į½øö·“Ó¦ÖŠ¶¼Ö»ÓŠŅ»ÖÖŌŖĖŲ»ÆŗĻ¼Ū·¢Éśøıä | |
| B£® | Į½øö¹ż³ĢÉś³ÉKClµÄĪļÖŹµÄĮæĻąĶ¬ | |
| C£® | ·¢ÉśŃõ»Æ·“Ó¦µÄŌŖĖŲĻąĶ¬ | |
| D£® | ·¢Éś»¹Ō·“Ó¦µÄŌŖĖŲĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Õż·“Ó¦»ī»ÆÄÜŠ”ÓŚ125.4kJ•mol-1 | |
| B£® | Äę·“Ó¦»ī»ÆÄÜŅ»¶ØŠ”ÓŚ125.4kJ•mol-1 | |
| C£® | Äę·“Ó¦»ī»ÆÄܲ»Š”ÓŚ125.4kJ•mol-1 | |
| D£® | Õż·“Ó¦»ī»ÆÄܱČÄę·“Ó¦»ī»ÆÄÜ“ó125.4kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 400mL 1mol/L NaClČÜŅŗ | B£® | 200mL 2mol/L AlCl3ČÜŅŗ | ||
| C£® | 100mL 1mol/L BaCl2ČÜŅŗ | D£® | 100mL 4mol/L KClČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ÅēČŖŹĒŅ»ÖÖ³£¼ūµÄ×ŌČ»ĻÖĻó£¬Ęä²śÉśµÄŌŅņŹĒ“ęŌŚŃ¹Ēæ²ī£®ÖĘČ”°±Ęų²¢Ķź³ÉÅēČŖŹµŃé£ØĶ¼ÖŠ¼Š³Ö×°ÖĆ¾łŅŃĀŌČ„£©£®
ÅēČŖŹĒŅ»ÖÖ³£¼ūµÄ×ŌČ»ĻÖĻó£¬Ęä²śÉśµÄŌŅņŹĒ“ęŌŚŃ¹Ēæ²ī£®ÖĘČ”°±Ęų²¢Ķź³ÉÅēČŖŹµŃé£ØĶ¼ÖŠ¼Š³Ö×°ÖĆ¾łŅŃĀŌČ„£©£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | pH=5µÄH2SČÜŅŗÖŠ£¬c£ØH+£©=c£ØHS-£©=1”Į10-5mol•L-1 | |
| B£® | pHĻąĶ¬µÄ¢ŁCH3COONa ¢ŚNaHCO3 ¢ŪNaClOČżÖÖČÜŅŗµÄc£ØNa+£©£ŗ¢Ł£¾¢Ś£¾¢Ū | |
| C£® | pH=2µÄH2C2O4ČÜŅŗÓėpH=12µÄNaOHČÜŅŗČĪŅā±ČĄż»ģŗĻ£ŗc£ØNa+£©+c£ØH+£©ØTc£ØOH-£©+c£ØHC2O4-£© | |
| D£® | pH=aµÄ°±Ė®ČÜŅŗ£¬Ļ”ŹĶ10±¶ŗó£¬ĘäpH=b£¬Ōņa=b+1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĢśŗĶĻ”ĻõĖį·“Ó¦ Fe+2H+ØTFe2++H2”ü | |
| B£® | ĀČ»ÆĢśČÜŅŗµĪČė·ŠĖ® Fe3++3H2O $\frac{\underline{\;\;”÷\;\;}}{\;}$ Fe£ØOH£©3”ż+3H+ | |
| C£® | ĻõĖįŅųČÜŅŗÖŠµĪČėŹ³ŃĪĖ® NaCl+Ag+ØTAgCl”ż+Na+ | |
| D£® | ĀČĘųĶØČėÉÕ¼īČÜŅŗ Cl2+2OH-ØTCl-+ClO-+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ĀČĘųµÄŹµŃéŹŅÖĘ·ØŹĒMnO2ŗĶÅØŃĪĖįŌŚ¼ÓČČĢõ¼žĻĀ·“Ó¦£¬Čō½«MnO2»»³ÉKMnO4”¢KClO3µČŃõ»Æ¼ĮŃõ»ÆÅØŃĪĖįŅąæÉæģĖŁÖĘČ”ĀČĘų£®øł¾ŻÉĻŹö·“Ó¦ŌĄķ£¬ÓŠČĖĢį³ö²ĀĻė£ŗÄÜ·ńĄūÓĆNa2O2µÄĒæŃõ»ÆŠŌŃõ»ÆÅØŃĪĖįµĆµ½ĀČĘųÄŲ£æijæĪĶāŠ”×éŌŚŹµŃéŹŅ½ųŠŠĮĖĢ½Ė÷ŠŌŹµŃ飬Éč¼ĘĮĖČēĶ¼ĖłŹ¾×°ÖĆ£ŗ
ĀČĘųµÄŹµŃéŹŅÖĘ·ØŹĒMnO2ŗĶÅØŃĪĖįŌŚ¼ÓČČĢõ¼žĻĀ·“Ó¦£¬Čō½«MnO2»»³ÉKMnO4”¢KClO3µČŃõ»Æ¼ĮŃõ»ÆÅØŃĪĖįŅąæÉæģĖŁÖĘČ”ĀČĘų£®øł¾ŻÉĻŹö·“Ó¦ŌĄķ£¬ÓŠČĖĢį³ö²ĀĻė£ŗÄÜ·ńĄūÓĆNa2O2µÄĒæŃõ»ÆŠŌŃõ»ÆÅØŃĪĖįµĆµ½ĀČĘųÄŲ£æijæĪĶāŠ”×éŌŚŹµŃéŹŅ½ųŠŠĮĖĢ½Ė÷ŠŌŹµŃ飬Éč¼ĘĮĖČēĶ¼ĖłŹ¾×°ÖĆ£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com