
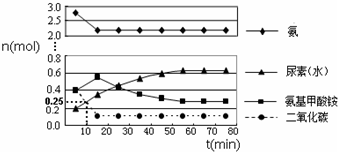
���� ��1����֪�ܷ�Ӧ�Ŀ���������һ�����������ͼ��仯���ƽ����жϣ���Ӧ�����������ݵ�һ���͵ڶ�����Ӧ������б�ʱȽϴ�С������ͼ�����������������������ƽ�⣻
��2������ͼ�����10����ʱ������̼���������ʵ�������ϻ�ѧ��Ӧ���ʸ�����м��㣻
��3�����¡��������ٳ���һ��������He����ƽ�ⲻ����Ӱ�죮
��� �⣺��1����ͼ���֪��15�������ң������Ͷ�����̼��Ӧ���ɰ�������狀��ٱ仯���������ǵ�һ����Ӧ������������������ټ�С���ﵽƽ�⣬�������ǵڶ�����Ӧ��������б�ʲ��ѿ����ڶ�����Ӧ����������֪�ܷ�Ӧ�Ŀ���������һ���������ʺϳ������ܷ�Ӧ�Ŀ����ɵڶ�������������ͼ�����55minʱ������������������ƽ�⣻
�ʴ�Ϊ������55��
��2������ͼ�������������̼�ٽ��е�10minʱ���ʵ���Ϊ0.25mol�����Դ�ʱ�ķ�Ӧ����Ϊ=$\frac{\frac{1mol-0.25mol}{500L}}{10min}$=1.5��10-4mol/��L•min����
�ʴ�Ϊ��1.5��10-4mol/��L•min����
��3�����¡��������ٳ���һ��������He����ƽ�ⲻ����Ӱ�죬��CO��NH2��2��l�����������䣬
�ʴ�Ϊ�����䣮
���� ���⿼�黯ѧƽ���Ӱ�����ط�������ѧ��Ӧ���ʵ�Ӱ�������жϣ�ͼ�������Ӧ�Ľ��г̶ȣ���Ŀ�Ѷ��еȣ�


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �Թ�1 | �Թ�2 | |
| ʵ������ | ��ɫ�ܿ� | ��ɫ���� |
| ��ɫʱ��/s | 4�� | 31�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2+CuO�TCu+H2O | B�� | 2Na2O2+2H2O�T4NaOH+O2�� | ||
| C�� | H2+Cl2�T2HCl | D�� | 2NaOH+Cl2�TNaCl+NaClO+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaH2PO4��ҺPH��7��������Һ�У�c��Na+����c��H2PO4-����c��H3PO4����c��HPO42-�� | |
| B�� | 0.1mol•L-1��NH4��2SO4��Һ��0.1mol•L-1NH3•H2O��Һ�������ϣ�c��NH4+��+c��H+��=2c��SO42-��+c��OH-�� | |
| C�� | 0.1mol•L-1CH3COONa��Һ��0.1mol•L-1CH3COOH��Һ�������ϣ�pH��7��c��CH3COOH����c��Na+����c��CH3COO-����c��H+�� | |
| D�� | 0.2mol•L-1NaHCO3��Һ��0.1mol•L-1Na2CO3��Һ�������ϣ�2c��Na+��=3c��CO32-��+3c��HCO3-��+3c��H2CO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10 mol | B�� | 11 mol | C�� | 12 mol | D�� | 13 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 8�� | B�� | 6�� | C�� | 4�� | D�� | 3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪�������ȼ��Ϊ�£�N2H4����������Ϊ�������⣬������ֹ��������ѺϽ���ϣ���ش��������⣺
��֪�������ȼ��Ϊ�£�N2H4����������Ϊ�������⣬������ֹ��������ѺϽ���ϣ���ش��������⣺| ���� | �۵�/K | �е�/K | ˮ���ܽ�ȣ���״���� |
| H2S | 187 | 202 | ÿ��ˮ���ܽ�2.6L |
| H2O2 | 272 | 423 | ������Ȼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�1 L 0.1 mol•L-1 ��NH4NO3��Һ�е�ԭ����Ϊ0.2NA | |
| B�� | ��״���£�2.24 L�����й��ۼ���ĿΪ1.9NA | |
| C�� | �����£�28.0 g��ϩ�Ͷ�ϩ�Ļ�������к��е�̼ԭ����Ϊ2NA | |
| D�� | ����Fe���״����22.4 L Cl2��ַ�Ӧ��ת�Ƶĵ�����Ϊ2NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com