

分析 (1)已知①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1,又知C和CO的燃烧热(△H)分别为-393.5kJ•mol-1和-283kJ•mol-1,可得热化学方程式:②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1、③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1,根据盖斯定律,③×2-①可得:2NO(g)+2CO(g)═N2(g)+2CO2(g),据此计算出该反应的焓变;
(2)①根据v=$\frac{△c}{△t}$计算在0-9min内CO的平均反应速率v(CO);
12min时改变条件瞬间各组分浓度不变,而氮气浓度增大,NO、CO浓度减小,平衡正向移动,结合平衡移动原理分析解答;
②由①中可知12min时为改变温度,重新到达平衡时NO为0.14mol/L、CO为0.04mol/L、氮气为0.03mol/L,由2NO(g)+2CO(g)═N2(g)+2CO2(g)可知二氧化碳为0.06mol/L,二氧化碳体积分数=$\frac{平衡时二氧化碳浓度}{混合气体总浓度}$×100%;根据K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{c(NO)•{c}^{2}(CO)}$计算平衡常数;
(3)①Na2SO3跟盐酸的反应是分步进行的:Na2SO3+HCl=NaHSO3+NaCl,NaHSO3+HCl=NaCl+H2O+SO2↑,由图象可知生成二氧化硫消耗的HCl的物质的量小于从反应到开始产生二氧化硫阶段消耗的HCl,则氢氧化钠与二氧化硫反应后的溶质为NaOH、Na2SO3;
②a点氢氧化钠、亚硫酸钠都恰好与HCl反应生成0.2mol亚硫酸氢钠、0.3mol氯化钠,结合盐的水解原理判断各离子浓度大小.
解答 解:(1)已知①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
又知C和CO的燃烧热(△H)分别为-393.5kJ•mol-1和-283kJ•mol-1
可得热化学方程式:②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1
根据盖斯定律,③×2-①可得:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5KJ/mol,
故答案为:-746.5;
(2)①0-9min内CO浓度变化为:(0.1-0.06)mol/L=0.04mol/L,则CO在0-9min内的平均反应速率为:v(CO)=$\frac{0.04mol/L}{9min}$=4.4×10-3L-1•min-1,
根据图示可知,12min时改变条件瞬间,各组分浓度不变,而氮气浓度增大,NO、CO浓度减小,平衡正向移动,正反应为放热反应,应是降低温度,
故答案为:4.4×10-3;D;
②由1中可知12min时为改变温度,重新到达平衡时NO为0.14mol/L、CO为0.04mol/L、氮气为0.03mol/L,由方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)可知二氧化碳为0.06mol/L,则二氧化碳体积分数=$\frac{0.06}{0.14+0.04+0.03+0.06}$×100%=22.2%;
该反应在该温度下的平衡常数为:K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{c(NO)•{c}^{2}(CO)}$=$\frac{0.03×0.0{6}^{2}}{0.1{4}^{2}×0.0{4}^{2}}$=3.4,
故答案为:22.2%;3.4;
(3)①Na2SO3跟盐酸的反应是分步进行的:Na2SO3+HCl=NaHSO3+NaCl,NaHSO3+HCl=NaCl+H2O+SO2↑,由图象可知生成二氧化硫消耗的HCl的物质的量小于从反应到开始产生二氧化硫阶段消耗的HCl,则氢氧化钠与二氧化硫反应后的溶质为:NaOH、Na2SO3,
故答案为:NaOH、Na2SO3;
②0点溶质为NaOH、Na2SO3,根据反应Na2SO3+HCl=NaHSO3+NaCl,NaHSO3+HCl=NaCl+H2O+SO2↑可知,Na2SO3转化成NaHSO3消耗HCl的物质的量等于NaHSO3转化成二氧化硫消耗HCl的物质的量,故Na2SO3的物质的量为:0.5mol-0.3mol=0.2mol,则n(NaOH)=0.3mol-0.2mol=0.1mol,
根据Cl、Na元素守恒可知a点溶质为:0.3molNaCl、0.2molNaHSO3,钠离子和氯离子不水解,而HSO3-发生电离和水解,则c(Na+)>c(Cl-)c(HSO3-);NaHSO3水溶液为酸性,说明HSO3-的电离程度等于其水解程度,则c(H+)>c(OH-),溶液中还存在水电离的氢离子,则c(H+)>c(SO32-)>c(OH-),
所以a点溶液中离子浓度大小为:c(Na+)>c(Cl-)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(Cl-)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
点评 本题考查了较为综合,涉及化学平衡常数、离子浓度大小比较、盖斯定律应用等知识,明确化学平衡及其影响为解答关键,注意掌握判断离子浓度大小的常用方法,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘盐 | 20~40mg/kg |
| 储藏方法 | 密封避光、防潮 |
| 使用方法 | 烹调时待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ④⑤ | C. | ③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
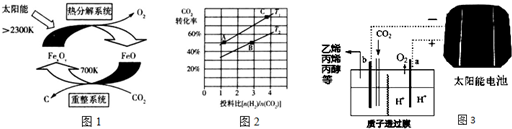
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9 mol | B. | 0.8 mol | C. | 0.6mol | D. | 0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
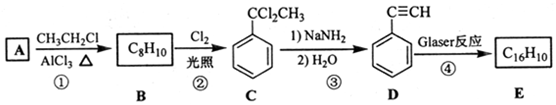
 ,D 的化学名称为苯乙炔.
,D 的化学名称为苯乙炔. .用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.
.用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.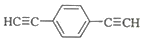 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n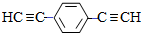 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$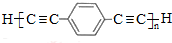 +(n-1)H2.
+(n-1)H2. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ③④⑤ | C. | 除④以外 | D. | ②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com