
| A. |  实验室制硝基苯 | B. | 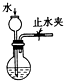 检查装置气密性 | ||
| C. |  利用排空气法收集丙烷 | D. | 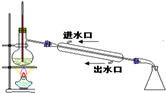 石油分馏 |
分析 A.水浴加热的温度为50~60℃;
B.关闭止水夹,利用液差法检验气密性;
C.丙烷的密度比与空气的密度大,应利用向上排空气法;
D.温度计测定馏分的温度,且冷却水下进上出.
解答 解:A.水浴加热的温度为50~60℃制备硝基苯,图中温度不合理,故A错误;
B.关闭止水夹,从长颈漏斗注入水,烧瓶与漏斗下端导管中出现液面法,一定时间液柱高度不变,则检验气密性良好,故B正确;
C.丙烷的密度比与空气的密度大,应利用向上排空气法收集,图中导管应长导管进气,故C错误;
D.温度计测定馏分的温度,且冷却水下进上出,图中温度计的温度、水流方向均不合理,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的制备实验、气体的收集、混合物分离提纯等为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲醇中含有C-H键的数目为4NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 1mol丙烯酸中含有双键的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
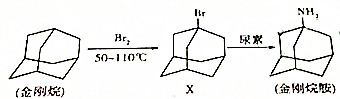
| A. | 金刚烷是不饱和烃 | B. | 金刚烷胺的分子式为C10H16N | ||
| C. | 上述反应都属于取代反应 | D. | X与尿素反应的另-种生成物是H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:F>Cl>S | B. | 熔点:I2>H2O>H2S | ||
| C. | 稳定性:HF>H2S>H2O | D. | 碱性:KOH>NaOH>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它能够导电 | |
| B. | 它含有人体所需的矿物质和多种微量元素 | |
| C. | 它不含任何元素 | |
| D. | 它清洁、纯净,但长期饮用对人健康无益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式可以表示为CH2CH2 | |
| B. | 甲烷和苯都能发生取代反应 | |
| C. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| D. | 石油的分馏和煤的干馏都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
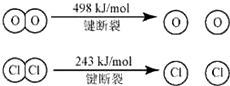
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com