
【题目】NA表示阿伏伽德罗常数,则下列说法正确的是( )
A.2.4g Mg变成Mg2+时失去的电子数为0.1 NA
B.标准状况下,11.2 L水所含的原子数为1.5 NA
C.在常温常压下,32g氧气所含原子数目为2NA
D.0.1mol/LK2SO4溶液含有 K+0.2 NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在加热的条件下,用MnO2与100mL物质的量浓度为12mol/L的浓盐酸反应,制得氯气2.24L(标准状况).(已知MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
(1)需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
(3)若反应后溶液的体积不变,则反应后溶液中Cl﹣物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下: 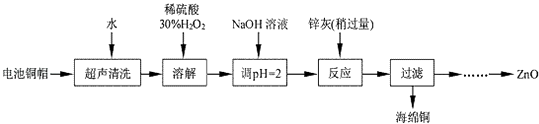
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式:;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下: 2Cu2++4I﹣=2CuI(白色)↓+I2 2S2O32﹣+I2=2I﹣+S4O62﹣
①滴定选用的指示剂为 , 滴定终点观察到的现象为;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点.再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为 , (结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀.已知KSP[Cu (OH)2]=2.0×10﹣20(mol/L)3 , 计算沉淀生成后溶液中c(Cu2+)=mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2﹣ . 下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0molL﹣1计算).
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 1.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0molL﹣1HNO3、1.0molL﹣1NaOH.由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2 , 使其充分反应;
②;③过滤;
④;⑤过滤、洗涤、干燥;⑥900℃煅烧.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)CO(g)+3H2(g).
(1)每消耗8gCH4转移mol电子.
(2)已知:①2CO(g)+O2(g)2CO2(g)△H1=akJmol﹣1②CO(g)+H2O(g)CO2(g)+H2(g)△H2=bkJmol﹣1
③CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=ckJmol﹣1
④CH4(g)+2H2O(g)CO(g)+3H2(g)△H4
由此计算△H4=kJmol﹣1 .
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2OCO(g)+3H2(g) 经过tmin,反应达到平衡.已知平衡时,c(CH4)=0.5molL﹣1
①0~tmin内,该反应的平衡反应速率v(H2)= .
②T℃时,该反应的平衡常数K= .
③当温度升高到(T+100)℃时,容器中c(CO)=0.75molL﹣1 , 则该反应是反应(填“吸热”或“放热”).
(4)一种熔融碳酸盐燃料电池的工作原理示意图如图: ①该放电过程中K+和Na+向电极(填“A”或“B”)移动.
②该电池的负极反应式为 . 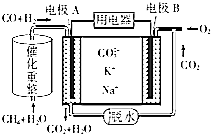
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1 L水中溶解了40 g NaOH后,所得溶液浓度为1 mol/L
B.从1 L 2 mol/L的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.将2.24 L(标准状况)HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol/L
D.配制1 L 0.2 mol/L的CuSO4溶液,需用25 g胆矾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com