
�������ƣ��ж��ԣ��г��Ϻ�����ʳ�λ�������һ�ֳ����Ĺ�ҵ���Σ��㷺�������ʺϳɡ��������洦���ȣ�����������NaCl��Ϊ���ơ���ػ�ѧ��������ͼ��ʾ������˵������ȷ����
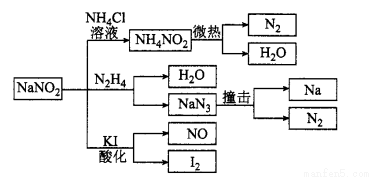
A����ͼʾ���漰����������ԭ��Ӧ��4��
B��NaNO2��N2 H4��Ӧ�У����������뻹ԭ��������ʵ���֮��Ϊ2:1
C������KI��������ֽ��ʳ����NaNO2��NaCl
D���ֽ�NaN3��ÿ����1 mol N2ת��6 mol e��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и������ʼ�����ǿ����Һ��Ӧ������ǿ����Һ��Ӧ����( )
��Al ��AlCl3 ��Na AlO2 ��Al(OH)3 ��Al2O3 ��NaHCO3
A���٢ڢۢܢݢ� B���٢ۢܢ� C���ܢ� D���٢ܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ������ѧ�ڵڶ���ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��25�桢1.01��105Pa�£���22gCO2ͨ�뵽750mL1.0mol��L-1��NaOH��Һ�г�ַ�Ӧ���ų�x kJ�������ڸ�������1molCO2ͨ�뵽2L 1.0mol��L-1��NaOH��Һ�г�ַ�Ӧ���ų�ykJ��������CO2��NaOH��Ӧ����NaHCO3���Ȼ�ѧ��Ӧ����ʽΪ
A��CO2(g)+NaOH(aq)=NaHCO3(aq) ��H = -(2y-x)kJ��mol��1
B��CO2(g) + NaOH(aq) = NaHCO3(aq) ��H = -(4x-y)kJ��mol��1
C��CO2(g) + NaOH(aq) = NaHCO3(aq) ��H = -(2x-y)kJ��mol��1
D��CO2(g) + NaOH(aq) = NaHCO3(aq) ��H = -(8x-2y)kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�Ͼ�����У������ѧ��12��������ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶�ʱ�����ݻ�Ϊ2L���ܱ������г���һ������SO2��O2��������Ӧ��2SO2(g)+O2(g) 2SO3(g) ∆H��?196kJ��moL?1��һ��ʱ����ƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
2SO3(g) ∆H��?196kJ��moL?1��һ��ʱ����ƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
����˵������ȷ����
A����Ӧ��ǰ5min��ƽ������Ϊv (SO2)=0.08mol��L?1��min?1
B�������¶Ȳ��䣬��ƽ�����������ٳ���0.2molSO2��0.2mol SO3ʱ��v (��)��v (��)
C�����������������䣬����ʼʱ�������г���2molSO3����ƽ��ʱ����78.4kJ������
D����ͬ�¶��£���ʼʱ�������г���1.5mol SO3����ƽ��ʱSO3��ת����Ϊ40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й��������ʻ�Ӧ�õ�˵����ȷ����
A���ƵĽ����Աȼ�ǿ����ҵ��������ȡ�أ�Na+K K��+NaCl��
K��+NaCl��
B������Al2O3�����������������������ռ�
C����ˮ��Ͳ�������ʯ��ʯ��ԭ��
D����������ǿ���ԣ��������ʴ�̲���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���Ϻ���ʮ��У������ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ�ʵ����
�������ƺ����ͨ�����Ϸ�Ӧ���Ƶ����������(Na2S2O3)��
��֪��Na2S2O3��������Һ�в����ȶ����ڡ��й����ʵ��ܽ�����¶ȱ仯����������ͼ��ʾ��ij�о�С��������Ʊ�Na2S2O3��5H2O������װ��ͼ ��


���ֲ����������£�
�ٴ�K1���ر�K2����Բ����ƿ�м�������Ũ���ᣬ���ȡ�
��C�л��Һ��������������Ӧһ��ʱ�����۵������١�
��C����Һ��pH�ӽ�7ʱ����ֹͣC�еķ�Ӧ��ֹͣ����
�۹���C�еĻ��Һ��������Һ���д������õ���Ʒ��
31��������У�Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽ�� ��
32��������У�����C����Һ��pH�ӽ�7ʱ��ֹͣC�еķ�Ӧ����ԭ���� ����ֹͣC�еķ�Ӧ���IJ����� ��
33��������У������ˡ��õ��IJ����������ձ��� �� (����������)������Һ���д��������ǽ���Һ���� �� �����ˡ�ϴ�ӡ���ɣ��õ���Ʒ��
���ݷ�Ӧ2S2O32�� + I2 �� S4O62�� + 2I��������I2�ı���Һ�ⶨ��Ʒ�Ĵ��ȡ�ȡ5.5g��Ʒ���Ƴ�100mL��Һ��ȡ10mL��Һ���Ե�����ҺΪָʾ������Ũ��Ϊ0.050 mol/L I2�ı���Һ���еζ���������ݼ�¼���±���ʾ��
��� | 1 | 2 | 3 | 4 |
��Һ�����/mL | 10.00 | 10.00 | 10.00 | 10.00 |
����I2����Һ�����/mL | 19.99 | 19.98 | 17.13 | 20.03 |
34���жϴﵽ�ζ��յ�������� ��
35��Na2S2O3�� 5H2O�ڲ�Ʒ�е����������� ��(���������ðٷ�����ʾ������1λС��)(Na2S2O3�� 5H2O��ʽ��Ϊ248)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���Ĵ�ʡ������ѧ��12���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�л���A�Ľṹ��ʽ��ͼ��ʾ��ijͬѧ������ܾ��еĻ�ѧ���ʽ���������Ԥ�⣬������ȷ����( )

�ٿ���ʹ���Ը��������Һ��ɫ
�ڿ��Ժ�NaOH��Һ��Ӧ
����һ�������¿��Ժ����ᷢ����Ӧ
����һ�������¿��Է�����ȥ��Ӧ
����һ�������¿��Ժ�����Cu(OH)2��Ӧ
A���٢ڢ� B���٢ڢۢ� C���٢ڢۢ� D���٢ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�갲��ʡ�߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�й��ڻ�ѧ��Դ�������������
A��Ǧ�����и�����PbO2�ĵ缫���Ǹ�����
B����ͨп�̸ɵ����̼��Ϊ����
C������ȼ�ϵ�ص�������ͨ����������һ��
D������п�̸ɵ�صı������ʹ���ʱ�����ͨп�̸ɵ�ظ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʡ®������У������ѧ�ڵ��Ĵ�������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й����ʷ����������ԭ��������ȷ����( )
A������������һ���Ƿǽ��������������ɢϵ�������д�����ϵ
B��Ԫ�صĵ��ʿ���������ԭ����Ԫ�صĻ��������Ƶ�
C���õ���Խ������������������Ծ�Խǿ�������Ԫ�صĻ�����һ������ǿ��������
D���ռ��ʯ�Ҿ����ڼ�ᡢ���֮�䷢���ķ�Ӧ�����ڸ��ֽⷴӦ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com