
甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )
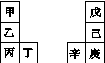
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列离子方程式不正确的是( )
A.醋酸溶液中加入少量氢氧化镁固体:Mg(OH)2+2CH3COOH===Mg2++2CH3COO-+2H2O
B.H2O2溶液中加入足量酸性KMnO4溶液:2MnO +3H2O2+6H+===2Mn2++6H2O+4O2↑
+3H2O2+6H+===2Mn2++6H2O+4O2↑
C.Ca(HCO3)2溶液中加入足量澄清石灰水:Ca2++HCO +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
D.NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO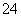 恰好沉淀完全:NH
恰好沉淀完全:NH +H++SO
+H++SO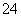 +Ba2++2OH-===NH3·H2O+BaSO4↓+H2O
+Ba2++2OH-===NH3·H2O+BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72−和CrO42−,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72−的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是_______________________________。
(2)阴极附近溶液pH升高的原因是_______________________________(用电极反应式解释);溶液中同时生成的沉淀还有________________。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:

已知:①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
(3)步骤②中加双氧水的目的是_________________________,pH控制在3.4的作用是_____________________________;已知25℃时,Ksp[Cu(OH)2]=2.0×10-20,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K=_______________。
Cu(OH)2+2H+的平衡常数K=_______________。
(4)制备氮化铁的反应:Fe+NH3 FexNy+H2(未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为___________。
FexNy+H2(未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.铝片与NaOH溶液反应:Al+2OH-===AlO +H2↑
+H2↑
B.稀硝酸中加入少量碳酸亚铁:FeCO3+2H+===Fe2++CO2↑+H2O
C.饱和碳酸钠溶液中通入二氧化碳气体:2Na++CO +CO2+H2O===2NaHCO3↓
+CO2+H2O===2NaHCO3↓
 D.Ba(OH)2与过量的NH4HSO4反应:Ba2++2OH-+2H++SO
D.Ba(OH)2与过量的NH4HSO4反应:Ba2++2OH-+2H++SO ===BaSO4↓+2H2O
===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中对应关系正确的是( )
| A | CH3CH3+Cl2 CH2===CH2+HCl―→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br-===2Cl-+Br2 Zn+Cu2+===Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O===4NaOH+O2↑ Cl2+H2O===HCl+HClO | 均为水作还原剂的氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl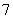 和AlCl
和AlCl 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,______________(填“能”或“ 不能”)说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能达到实验目的的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3===Na++H++CO
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO )+c(CO
)+c(CO )
)
D. 温度升高,c(HCO )增大
)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com