
【题目】已知A、B、C、D、E为第二至第四周期的元素,其原子序数依次增大。A原子最外层电子数是其内层电子总数的2倍,B原子s轨道上的电子数与p轨道上的电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。请回答下列问题:
(1)基态E原子的价电子排布式为____。
(2)A和B中,第一电离能较大的是___(填元素符号);B的简单氢化物的立体构型是__,中心原子的杂化类型是___。
(3)A22-和B22+互为等电子体,B22+的电子式可表示为____,1 mol B22+中含有的π键数目为____。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键_______________。
(5)化合物DC2的晶胞结构如图所示,该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是_____cm3(只要求列算式,阿伏加德罗常数的值为NA)。
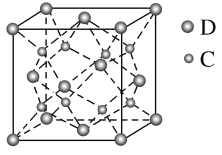
【答案】3d54s1 O V形 sp3 [:OO:]2+ 2NA F—H…F、F—H…O、O—H…F、O—H…O ![]()
【解析】
A、B、C、D、E都是前四周期的元素,它们的原子序数依次增大。A原子最外层电子数是其内层电子总数的2倍,则A原子有2个电子层,最外层电子数为4,故A为碳元素;C在元素周期表的各元素中电负性最大,则C为氟元素;B原子s轨道上的电子数与p轨道上的电子数相等,且原子序数小于氟元素的原子序数,则B为氧元素;D的基态原子核外有6个能级且全部充满电子,其核外电子排布式为1s22s22p63s23p64s2,则D为钙元素;E为第四周期元素,且E原子基态时未成对电子数是同周期元素中最多的,则E为铬元素。据此解答。
(1)E为Cr,基态Cr原子的价电子排布式为3d54s1;
(2)A为C,B为O,第一电离能较大的是O;B的简单氢化物为H2O,中心氧原子价层电子对数为![]() ,为sp3杂化,有2对孤电子对,空间构型为V形;
,为sp3杂化,有2对孤电子对,空间构型为V形;
(3)C22与O22+互为等电子体,结构相似,O22+带两个正电荷,价电子数为6+6-2=10,电子式可表示为[:OO:]2+;氧氧三键中有两个π键,1 mol O22+中含有的π键数目为2NA;
(4)HF水溶液中存在的所有氢键为F—H…F、F—H…O、O—H…F、O—H…O;
(5)由化合物CaF2的晶胞结构可知,晶胞中含有钙原子的数目为8×![]() +6×
+6×![]() =4,含有氟原子的数目为8,故该晶胞的质量为
=4,含有氟原子的数目为8,故该晶胞的质量为![]() ,该离子化合物晶体的密度为a g·cm-3,则晶胞的体积=
,该离子化合物晶体的密度为a g·cm-3,则晶胞的体积=![]() =
=![]() cm3。
cm3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利尿酸在奥运会上被禁用,其结构简式如下图所示。下列叙述正确的是( )

A. 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B. 利尿酸分子内处于同一平面的原子不超过10个
C. 1 mol利尿酸能与7 mol H2发生加成反应
D. 利尿酸能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。下列关于海洋氮循环的说法正确的是
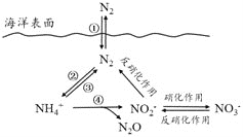
A. 海洋中的氮循环起始于氮的氧化
B. 海洋中的氮循环属于固氮作用的是③
C. 海洋中的反硝化作用一定有氧气的参与
D. 向海洋排放含NO3—的废水会影响海洋中NH4+的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=_________。
(2)合成尿素的反应:2NH3(g)+CO(g)CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=_________。
已知:
温度/K | 398 | 498 | … |
平衡常数(K) | 126.5 | K1 | … |
则:K1________(填“>”或“<”)126.5;其判断理由是__________。
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:
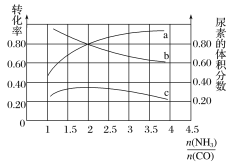
①若图中c表示平衡体系中尿素的体积分数,则a表示________的转化率。
②当![]() =________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。
=________时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____(写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同。下列叙述正确的是

A.WX的水溶液呈中性
B.元素非金属性的顺序为Y>Z>Q
C.Z的最高价氧化物对应的水化物是一元强酸
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是

A.Kb2的数量级为10-8
B.X(OH)NO3水溶液显酸性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中 c(X2+)>c[X(OH)+]
D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液中或熔融状态下可以导电的化合物称为电解质 | CH3COOH水溶液中存在:CH3COOH |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 | H2O既是酸又是碱 |
C | Fe3Cl8可以改写为FeCl2·2FeC13 | Fe3I8可以改写为FeI·2FeI3 |
D | HCl在一定条件下能被MnO2氧化为Cl2 | HBr在一定条件下也能被MnO2氧化为Br2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com