
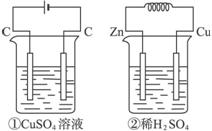
图4-4
A.产生气体的体积:①>②
B.电极上析出固体物质的质量:①>②
C.溶液pH变化:①增大,②减少
D.电极反应式:
①中阳极:4OH--4e-====2H2O+O2↑;
②中负极:2H++2e-====H2↑
解析:①为电解CuSO4溶液,两极反应分别为:
阴极:2Cu2++4e-====2Cu
阳极:4OH--4e-====2H2O+O2↑
总反应式为:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
②为原电池,两极反应为:
负极:Zn-2e-====Zn2+
正极:2H++2e-====H2↑
总反应式为:Zn+H2SO4![]() ZnSO4+H2↑
ZnSO4+H2↑
当通过0.02 mol电子时,①中阳极产生0.005 mol O2,②中产生0.01 mol H2;①中阴极析出0.01 mol Cu,②中没有固体析出;①电解后有H2SO4生成,溶液pH变小,②消耗H2SO4,溶液pH变大。
答案:B


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:

图4-15
A.产生气体的体积①>②
B.电极上析出固体物质的质量①>②
C.溶液pH变化①增大②减少
D.电极反应式:①中阳极:4OH--4e-![]() 2H2O+O2↑
2H2O+O2↑
②中负极2H++2e-![]() H2↑
H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。![]()
![]()
![]()
![]()
![]()

![]()
![]()

⑵天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图4-4所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
查看答案和解析>>
科目:高中化学 来源: 题型:
图4-4
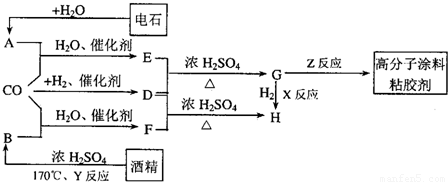
已知:
Ⅰ.RX![]() RCN
RCN![]() RCOOH(X表示卤素原子,下同)
RCOOH(X表示卤素原子,下同)
Ⅱ.![]()
Ⅲ.当一取代苯继续发生取代反应时,新引进的取代基受到原取代基的影响而取代邻位、对位或间位。使新的取代基进入它的邻位、对位的取代基:—CH3、—NH2、—X;使新的取代基进入它的间位的取代基有:—COOH、—NO2等。
请结合上述所给的信息,回答问题:
(1)反应②的条件:____________________________________________________。
(2)有人认为,若将②、③两步反应顺序颠倒,也可以得到C,实际上是不妥的。请你指出不妥之处:_____________________________________________________________________。
(3)反应⑤的化学反应方程式:_____________________________________________________。
(4)请你设计D![]() E(C3H6O2)的合成路线。
E(C3H6O2)的合成路线。
要求:①合成过程中无机试剂任选,有机原料碳原子不超过2个;②合成反应流程图表示方法示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源:2009年浙江省高考化学模拟试卷(一)(解析版) 题型:解答题
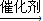 E; ②F+D
E; ②F+D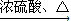 H.
H.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com