
| A. | x=0.5,a=8 | B. | x=0.5,a=10 | C. | x=1.5,a=8 | D. | x=1.5,a=10 |
分析 氧化还原反应中得失电子数相等,再结合原子守恒进行计算,以此解答该题.
解答 解:根据铬原子守恒得,1mol Cr2O72-完全反应后生成$\frac{2}{2-x}mol$FeⅡ[FeⅢx•CrⅢ2-x]O4,
根据铁原子守恒得amol=$\frac{2(1+x)}{2-x}mol$①,
该反应中得失电子数相等,1mol×2×(6-3)=$\frac{2}{2-x}mol$×x(3-2),6=$\frac{2}{2-x}$x,解得x=1.5,
将x=1.5代入①得a=10,
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,根据转移电子数相等及原子守恒来分析解答即可,难度不大.


科目:高中化学 来源: 题型:解答题
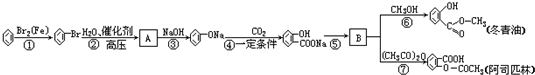
 ;
; .
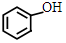
.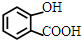 +NaHCO3→
+NaHCO3→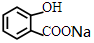 +CO2↑+H2O.
+CO2↑+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
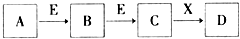
| A. | 若E为Fe,X是氢氧化钠,则A一定是氯气 | |
| B. | 若A为S,X为水,则A、B、C、D均可与氢氧化钠反应 | |
| C. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| D. | 若C是红棕色的气体,则A既可以是单质,也可以是化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
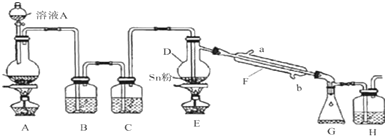
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
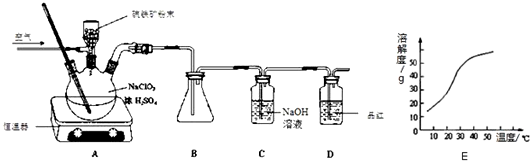
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
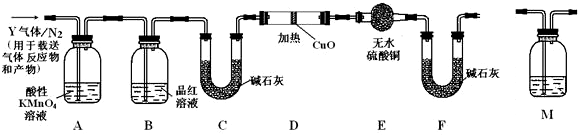
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
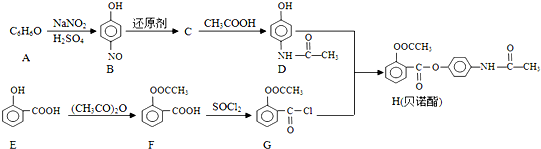
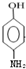 ;
;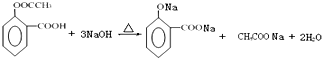 ;
;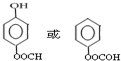 ;
;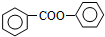 的合成路线流程图(无机试剂可任选):
的合成路线流程图(无机试剂可任选):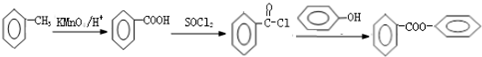 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
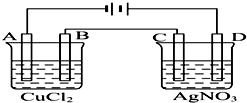 如图为以惰性电极进行电解的装置:
如图为以惰性电极进行电解的装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
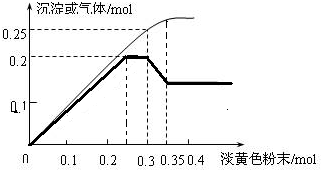 图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答:
图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com