
![]() һ�������������Ժ�CO2������Ӧ��Fe(s)��CO2(g)
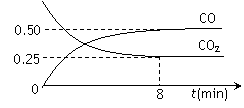
һ�������������Ժ�CO2������Ӧ��Fe(s)��CO2(g)![]() FeO(s)��CO(g)��1100��ʱ����ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
FeO(s)��CO(g)��1100��ʱ����ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
 |
|
|
�÷�Ӧ��ƽ�ⳣ������ʽK�� ��
�����д�ʩ����ʹƽ��ʱK������� ����ţ���
A�������¶� B������ѹǿ
C������һ����CO D���ټ���һЩ����
��8�����ڣ�CO��ƽ����Ӧ����V(CO)�� mol/(L��min)��
��1100��ʱ��2L���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й���������
| ���� | �� | �� |
| ��Ӧ��Ͷ���� | 3mol Fe��2mol CO2 | 4mol FeO��3mol CO |
| CO��Ũ�ȣ�mol��L | C1 | C 2 |
| CO2�ĵ�������� | ��1 | ��2 |
| ��ϵѹǿ��Pa�� | p1 | p2 |
| ��̬��Ӧ���ת���� | ��1 | ��2 |
������˵����ȷ���� ��
A��2C1 =3C 2 B����1 =��2 C��p1 ��p2 D����1=��2
����C1����1����2
���̣�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��
��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g�� FeO��s��+CO��g������H��0
FeO��s��+CO��g������H��0| c(CO) | c(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2011?����ģ�⣩һ�������������Ժ�CO2������Ӧ��
��2011?����ģ�⣩һ�������������Ժ�CO2������Ӧ�� FeO��s��+CO��g������H��0
FeO��s��+CO��g������H��0�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?��������ģ������һ����Ҫ�Ľ��������ĵ��ʼ����������Ÿ��Ե����ʣ�һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g������֪�÷�Ӧ��ƽ�ⳣ����K�����¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��
��2012?��������ģ������һ����Ҫ�Ľ��������ĵ��ʼ����������Ÿ��Ե����ʣ�һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g������֪�÷�Ӧ��ƽ�ⳣ����K�����¶ȣ�T���Ĺ�ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
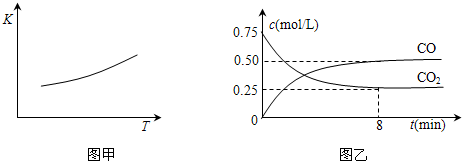
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�����ʡ�����и�����ѧ�ڵ��Ĵ��¿������ۣ���ѧ���� ���ͣ������
һ�������������Ժ�CO2������Ӧ��
Fe(s)+CO2(g) FeO(s)+CO(g)����H>0
FeO(s)+CO(g)����H>0

��1��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ����8������CO��ƽ����Ӧ����v(CO)= ��
��2�����д�ʩ����ʹƽ��ʱc(CO)/c(CO2)������� ������ţ���
A�������¶� B������ѹǿ C������һ�������� D���ټ���һЩ����
��3����Ӧ�ﵽƽ��������������������ʱ����ͨ��������CO2����CO2��ת���ʽ�
�����������С���������䡱��
��4��������Ҫ������������������Ӧ��ʮ�ֹ㷺��
��FeSO4��Һ���Թ�����NH4HCO3��Һ��ϣ��ɵú�FeCO3����Һ����FeCO3��Һ��ʱ�䱩¶�ڿ����У����������Ϊ���ɫ��д����FeCO3���ɺ��ɫ���ʵķ�Ӧ�Ļ�ѧ����ʽ�� ��
�ڸ�������(Na2FeO4)��һ����������ˮ������������������������֮һ�ǣ�ǿ������Һ����NaClO����Fe(OH)3���ɸ������ơ��Ȼ��ƺ���һ�ֳ���������÷�Ӧ�����ӷ���ʽΪ ��
��5����֪��2CO(g) + O2(g) == 2CO2(g)����H=��566 kJ��mol-1
2H2(g) + O2(g) == 2H2O(g)����H=��483.6 kJ��mol-1
д��CO��H2O(g)��������CO2��H2���Ȼ�ѧ����ʽ:
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com