
【题目】海带中富含碘元素.从海带中提取碘有如下步骤:( ) ①将海带焙烧成灰(生成KI) ②加水使KI溶解,充分搅拌后过滤 ③在滤液通入足量Cl2
④加CCl4振荡 ⑤静置后,用分液漏斗分液 合理的操作顺序是.
A.①②③④⑤
B.②⑤①③④
C.①③⑤②④
D.②①③⑤④
科目:高中化学 来源: 题型:
【题目】标准状况下,22.4LHCl气体溶于50mL水再配成250mL溶液:
(1)求所得盐酸的物质的量浓度_____
(2)若将此溶液再稀释成1L溶液,求稀释后盐酸的物质的量浓度_____
(3)将(2)的溶液取出500mL与足量的Zn反应可以产生多少体积的H2(在标准状况下)_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计了如下从海带灼烧后的海带灰中提取碘单质的流程:
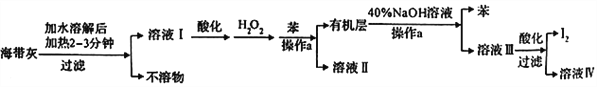
(1)溶解海带灰时要加热煮沸2~3min的目的是_________,操作a的名称是 _______。
(2)向酸化的溶液I中加入H2O2的目的是__________________________________。
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,则发生反应的化学方程式是________________________________。
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是______。
a.热水 b.乙醇 c.冷水 d.二硫化碳
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI。取5.0g产品,配制成100ml溶液。取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0.050mol·L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗Na2S2O3标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是________,碘单质在产品中的质量分数是________% 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型中温全瓷铁一空气二次电池,其结构如图所示。下列有关该电池的说法正确的是

A. 放电时O2-从a移向b B. 放电时负极的电极反应为O2+4e-=2O2-
C. 充电时1molFe 氧化为FeOx,转移2xmole- D. 充电时a 与电源的负极相连。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2) 作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。某研究小组设计如图所示装置制备ClO2和NaClO2。已知: ClO2熔点一59℃、沸点11℃,常温下ClO2为黄绿色或橘黄色气体,ClO2浓度过高或受热易分解,甚至会爆炸。NaClO2 高于60℃时分解生成NaClO3和NaCl。

(1)装置连接好后,加入药品前需进行的操作是____________________________________。
(2)使用恒压分液漏斗的目的是_________________;仪器B 的作用是_________________。
(3)A 中反应为2NaClO3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O。
C 中反应的化学方程式是_______________, 冷水浴的目的是_________________________。
(4) 实验中持续通入空气能稀释生成的ClO2并将其排到C处。若空气的流速太慢可能造成的后果是_______________________________________。
(5)已知: ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH 的关系如图所示。当pH≤2.0 时,ClO2-也能被I- 完全还原为Cl-。反应生成的I2与Na2S2O3 反应的方程式: 2Na2S2O3+ I2= Na2S4O6 + 2NaI。
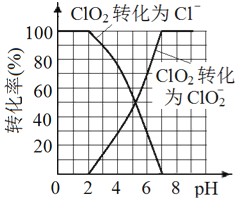
用ClO2消毒的饮用水中含有ClO2、ClO2-。测定饮用水中ClO2、ClO2-的含量,分两步进行:
①用紫外分光光度法测得水样中ClO2的含量为amol/L。
②用滴定法测量ClO2-的含量。请完成相应的实验步骤:
步骤1: 准确量取VmL 上述水样加入锥形瓶中。
步骤2: 调节水样的pH________。
步骤3: 加入足量的KI 晶体,充分反应。
步骤4: 加入少量淀粉溶液,用cmol/L Na2S2O3 溶液滴定至终点,消耗Na2S2O3 溶液V1mL。
根据上述分析数据,测得该饮用水中ClO2-的浓度为____mol/L( 用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。

(1)A中试剂为____________________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;②由A向B中滴加足量试剂;
③将B中剩余固体过滤,洗涤,干燥,称重;
④待B中不 再有气体产生并恢复至室温后,记录C的液面位置;
上述操作的顺序是_________(填序号);记录C的液面位置时,应________________ ,读数时视线_______。
(4)B中发生反应的离子方程式为____________________________________ 。
(5)若实验用铝镁合金的质量为m g,测得氢气体积为a mL(已换算为标准状况), B中剩余固体的质量为n g,则铝的相对原子质量为_____
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________。(填“偏大”、“偏小”或“不受影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑下列说法正确的是( )
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com