
 已知:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.
已知:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.分析 (1)23V原子核外有23个电子,根据核外电子排布规律来写;
(2)先根据三段式法计算出平衡时c(SO2),再根据转化率公式求出SO2的转化率;
(3)该反应是正反应气体体积减小的可逆反应,恒容容器比恒压容器,平衡正向反应程度大,逆向反应程度小;
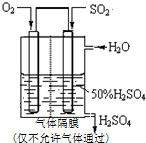
(4)通入SO2的电极是负极反应,二氧化硫失到电子生成硫酸根离子,在酸性溶液中生成氢离子;据电极反应式确定生成氢离子物质的量;根据SO2、O2和水形成硫酸溶液的浓度为50%,求出SO2和水的质量比.
解答 解:(1)23V原子核外有23个电子,核外电子排布为1s22s22p63s23p63d34s2,故答案为:1s22s22p63s23p63d34s2;
(2)根据V前/V后=n前/n后 可得,向一带活塞的体积为2L的密闭容器中充入2.0mol SO2和1.0mol O2,达到平衡后体积变为1.5L,n后=2.25mol
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
开始(mol) 2.0 1.0 0
反应(mol) a $\frac{1}{2}$a a
平衡(mol) 2.0-a 1-$\frac{1}{2}$a a
则:(2.0-a)+(1.0-$\frac{1}{2}$a)+a=2.25 a=1.5
所以SO2的转化率α=$\frac{1.5}{2}$×100%=75%,故答案为:75%;
(3)向容器中加入2.0mol SO2和1.0mol O2与加入2.0mol SO3平衡等效,该反应是正反应气体体积减小的可逆反应,恒容容器比恒压容器,平衡正向反应程度大,逆向反应程度小,容器体积不变,充入2.0mol SO3,达到平衡状态时,SO3的物质的量大于1.5mol,吸热多于$\frac{98KJ}{2}$=49kJ,少于98kJ,故答案为:49~98;
(4)通入SO2的电极是负极反应,二氧化硫失到电子生成硫酸根离子,在酸性溶液中生成氢离子,电极反应为:2SO2-4e-+4H2O=8H++2SO42-;通入O2电极的电极是正极反应,氧气得到电子生成氢氧根离子,在酸性溶液中生成水,电极反应为:O2+4e-+4 H+=2H2O,若该电池向外输送2mole-时,右侧n(H+)变化量为2mol,
设:SO2和水的质量分别为a、b
SO2 +H2O?H2SO3
64 18 82
a $\frac{18a}{64}$ $\frac{82a}{64}$
2H2SO3 +O2═2H2SO4
164 196
$\frac{82a}{64}$ $\frac{98a}{64}$
则:硫酸溶液的质量百分数为 $\frac{\frac{98a}{64}}{\frac{98a}{64}+b-\frac{18a}{64}}$×100%=50%,
所以a:b=16:29;
故答案为:2SO2-4e-+4H2O=8H++2SO42-;2mol;16:29.
点评 本题考查了核外电子排布、化学平衡的有关知、转化率的计算、外界条件对化学平衡的影响以及有关化学计算,试题较灵活,综合性强,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al是地壳中含量最多的元素 | |
| B. | Al2O3的熔点很高,是一种较好的耐火材料 | |
| C. | 向Al2(SO4)3溶液中滴加过量NaOH溶液制备Al(OH3) | |
| D. | 铝制品在生活中被广泛使用,说明铝是一种不活泼的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Al3+的氧化性依次减弱 | B. | RbOH、KOH、Mg(OH)2的碱性依次减弱 | ||
| C. | H2S、H2O、HF的稳定性依次增强 | D. | H4SiO4、H2SO4、HClO4酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味,表明乙醇已被铜氧化为乙醛 | |
| C. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 | |
| D. | 从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量H2O2溶液氧化,最后加入CCl4萃取分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及离子方程式 | 评价 |
| A | NaClO溶液中通入少量的SO2:ClO-+H2O+SO2═Cl-+SO42-+2H+ | 错误,碱性介质中 不可能生成H+ |
| B | 用酸性高锰酸钾溶液滴定草酸:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | 正确 |
| C | NH4Al(SO4)2溶液中滴入几滴NaOH溶液:NH4++OH-═NH3•H2O | 错误,OH-首先和Al3+反应 生成Al(OH)3沉淀 |
| D | 用惰性电极电解MgCl2溶液:2Mg2++2H2O $\frac{\underline{\;电解\;}}{\;}$ 2Mg+O2↑+4H+ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+m+n | B. | a-m-n | C. | a+m-n | D. | a-m+n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com