
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
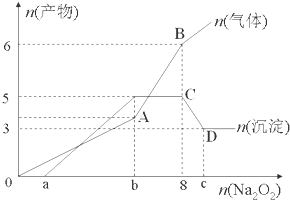
分析 (1)根据生成的沉淀总物质的量最大量为5mol、最终得到3mol可知,最终得到的沉淀为3mol氢氧化镁沉淀,溶解的2mol沉淀为氢氧化铝;根据气体的物质的量最后有增加可知,增加的气体为氨气,溶液中一定存在铵离子;根据开始加入过氧化钠时没有沉淀生成,说明原溶液中存在氢离子,根据题中数据计算出氢离子的物质的量;
(2)图象中所生成的气体和沉淀的量以及所加过氧化钠的量来计算各个点所对应的值;
(3)AB中过氧化钠与水反应、碱与铵根离子反应,CD中氢氧化铝与氢氧化钠溶液反应而导致沉淀减少,据此写出反应的离子方程式.
解答 解:(1)根据图象中沉淀先增加后部分溶解可知:溶液中一定含有:Mg2+和Al3+,所以一定不含CO32-、AlO2-,并且含有镁离子的物质的量为3mol,氢氧化铝和氢氧化镁沉淀一共是5mol,根据元素守恒,所以含有铝离子的物质的量2mol;
加入8mol过氧化钠会生成4mol氧气,而图象中生成了6mol气体,说明生成的气体除了过氧化钠和溶液反应生成的氧气之外,还一定有2mol其他气体生成,而只能是氨气,所以一定含有2mol铵根离子,所以一定不含有氢氧根离子;图象中加入过氧化钠的物质的量在0~amol之间时,没有沉淀生成,所以溶液中含有H+,由于加入8mol过氧化钠时生成的沉淀达到最大量5mol,8mol过氧化钠会生成16mol氢氧化钠,而生成2mol氢氧化铝、3mol氢氧化镁、2mol氨气消耗的氢氧化钠为:2mol×3+3mol×2+2mol=14mol,所以有2mol氢氧化钠与氢离子反应,氢离子的物质的量为2mol;
并且物质的量为2mol,溶液中一定还含有阴离子,可能为氯离子或溴离子,钾离子不能确定是否存在,
根据电荷守恒:所以n(H+)+3n(Al3+)+n(NH4+)+2n(Mg2+)≤2n(SO42-),所以氯离子物质的量≥16mol,即:
| 离子种类 | H+ | Al3+ | NH4+ | Mg2+ | Br-或Cl- | |
| 物质的量(mol) | 2 | 2 | 2 | 3 | ≥16 |
点评 本题考查常见的离子检验方法、离子方程式的书写,题目难度中等,注意掌握常见的离子检验方法,能够根据描述的反应现象判断存在的离子,注意掌握氢氧化铝的两性及反应的方程式.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者与盐酸反应的速率相同 |
| B | 将0.1mol•L-1Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1Na2SO4溶液 | 有白色沉淀并保持不变 | BaCO3不能转化为BaSO4 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将Kl和FeCl3溶液在试管中混合后,加入庚烷,振荡,静置 | 下层溶液显紫红色 | 生成的l2全部溶于庚烷中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
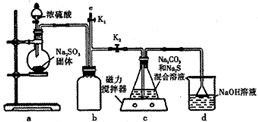 天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染.
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋 | 红色很快褪为无色 | 随溶液pH减小,NaClO的氧化能力增强 |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 苯酚和水的浊液中,加Na2CO3溶液 | 溶液变澄清 | 苯酚的酸性比碳酸强 |
| D | 向溶液X中加入NaHCO3粉末 | 产生无色气体 | 溶液X的溶质一定属于酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
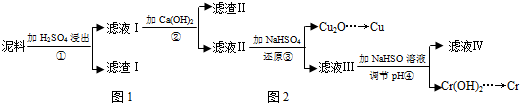
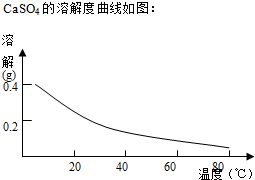
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+>I2>SO2>Cl2 | B. | Cl2>Fe3+>I2>SO2 | C. | I2>Cl2>Fe3+>SO2 | D. | Cl2>SO2>I2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com