




| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����




�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
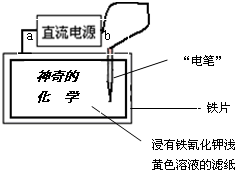 ��2012?�����ģ����֪����Fe2+����Һ�����軯��K3[Fe��CN��6]��Һ��Ӧ���ɾ���������ɫ�����軯�������������ӷ���ʽΪ��3Fe2++2[Fe��CN��6]3-�TFe3[Fe��CN��6]2����������ͼװ���ڽ������軯��dz��ɫ��Һ����ֽ��д����ɫ���֡�����Ļ�ѧ�����ݴ��ж�����˵����ȷ���ǣ�������
��2012?�����ģ����֪����Fe2+����Һ�����軯��K3[Fe��CN��6]��Һ��Ӧ���ɾ���������ɫ�����軯�������������ӷ���ʽΪ��3Fe2++2[Fe��CN��6]3-�TFe3[Fe��CN��6]2����������ͼװ���ڽ������軯��dz��ɫ��Һ����ֽ��д����ɫ���֡�����Ļ�ѧ�����ݴ��ж�����˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
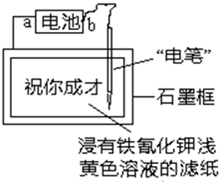 ��2011?������ģ����֪����Fe2+����Һ�����軯��K3[Fe��CN��6]��Һ��Ӧ���ɾ���������ɫ�����軯����������������ͼװ���ڽ������軯��dz��ɫ��Һ����ֽ��д��������ɫ���֡�ף��ɲš����ݴ��ж�����˵����ȷ���ǣ�������
��2011?������ģ����֪����Fe2+����Һ�����軯��K3[Fe��CN��6]��Һ��Ӧ���ɾ���������ɫ�����軯����������������ͼװ���ڽ������軯��dz��ɫ��Һ����ֽ��д��������ɫ���֡�ף��ɲš����ݴ��ж�����˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| ��ʼ����ʱ | 1.5 | 3.3 | 6.5 | 9.4 |
| ������ȫʱ | 3.7 | 5.2 | 9.7 | 12.4 |
| ƽ�вⶨ���� | ƽ��ֵ | ||||
| ʵ���� | 1 | 2 | 3 | 4 | |
| ���� H2O2��Һ�����/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
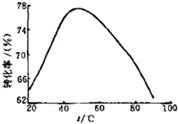
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com