
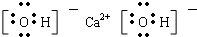 ,
,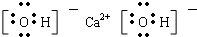 ;
; ;
; .
.

 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、这种纳米材料属于胶体,具有丁达尔效应 |
| B、聚乙烯塑料能使酸性高锰酸钾溶液褪色 |
| C、聚乙炔导电塑料结构似金属,存在阳离子和自由电子 |
| D、这种材料不属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、离子结构示意图 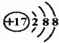 :可以表示35Cl-,也可以表示37Cl- :可以表示35Cl-,也可以表示37Cl- |
B、电子式 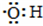 :可以表示羟基,也可以表示氢氧根离子 :可以表示羟基,也可以表示氢氧根离子 |
C、聚丙烯的结构简式: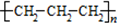 |
| D、溶液中,硫酸氢钠的电离方程式:NaHSO4═Na++HSO4- |
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省宿迁市五校高一上学期期中联考化学试卷(解析版) 题型:填空题
(10分)有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应的实验过程可用如图表示:
请回答下列问题:

(1)写出实验流程中下列物质化学式:试剂X ,沉淀A ,沉淀B 。
(2)①、②、③过程中均需要过滤,在进行此操作时需要用到的玻璃仪器为: 、 、 。
(3)上述实验流程中加入过量的Na2CO3的目的是 。
(4)按此实验方案得到的溶液3中肯定含有Na2CO3杂质;为了解决这个问题,可以向溶液3中加入适量的 ,之后若要获得固体NaNO3需进行的实验操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省宿迁市五校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列各项比较中,错误的是
A.碱性:NaOH>Al(OH)3
B.熔点:Al2O3>Al
C.热稳定性:Na2CO3>NaHCO3
D.硬度:纯铝>铝合金
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省蚌埠市高二上学期期中化学试卷(解析版) 题型:实验题
实验题(12分) 某化学课外小组用右图装置制取溴苯。
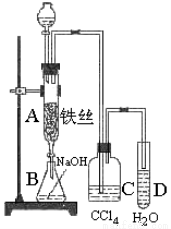
先向分液漏斗中加入苯和液溴 ,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式________________________
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是______________________,写出有关的化学方程式:____________________________________。
(3)C中盛放CCl4的作用是 。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入________,现象是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省高二上学期第一次质量检测化学试卷(解析版) 题型:填空题
(14分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

依据上图,完成下列填空:
(1)在电解过程中电解池中所发生总反应的离子方程式为:________ ,与电源负极相连的电极附近,溶液PH ________ 。(选填“不变”“升高”或“下降”)
(2)工业食盐中含Ca2+、Mg2+等杂质。精制过程中发生的离子方程式为 、 。
(3)若粗盐中SO42—含量较高,必须添加钡试剂除去SO42—,该钡试剂可以是 ;
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42—,加入试剂的合理顺序为 ;
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 。(填操作名称)除去NaCl。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com