
【题目】某同学设计下列方法对A盐的水溶液进行鉴定:
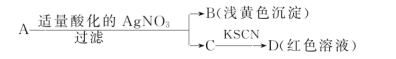
由此得出的结论中,不正确的是
A.D溶液中存在Fe(SCN)3 B.滤液C中有Fe3+
C.B为AgBr D.A一定是FeBr2
【答案】D
【解析】
试题A.由于C溶液中加入KSCN溶液,溶液变为血红色,则证明C中含有Fe3+,Fe3+与SCN-发生反应形成Fe(SCN)3,所以在D溶液中存在Fe(SCN)3,正确。 B.Fe3+与SCN-发生反应形成Fe(SCN)3,滤液C中加入KSCN溶液,溶液变为血红色,则证明在C中含有Fe3+,正确。C.向A溶液中加入酸酸化的AgNO3溶液,产生浅黄色沉淀,则不溶性的沉淀是AgBr,原溶液中含有Br-,正确。D.根据题意可知在原溶液中含有Br-,由于在酸性条件下NO3-表现氧化性,会把Fe2+氧化为Fe3+,在反应后的溶液C中含有Fe3+,可能是原溶液中含有的,也可能是氧化产生的,所以A可能是FeBr2,也可能是FeBr3,错误。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】下列有关认识正确的是( )
A. 各能级最多能容纳电子数按s、p、d、f的顺序分别为2、6、10、14
B. 各能层的能级都是从s能级开始至f能级结束
C. 各能层含有的能级数为n-1
D. 各能层含有的电子数为2n2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是

![]()
A. a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a
B. 电池工作时,化学能转化为电能和热能
C. 电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O
D. 当电路中通过4mol电子时,有4molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在100℃的温度下,水的离子积Kw=1×10-12,本题涉及的溶液,其温度均为100℃,下列说法中正确的是
A.0.001mol/L的硫酸溶液,pH=2
B.0.001mol/L的氢氧化钠溶液pH=9
C.0.005mol/L的硫酸溶液与0.01mol/L的氢氧化钠溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的硫酸溶液50mL,需要pH=11的NaOH溶液50mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用光洁铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察到火焰呈黄色。下列判断正确的是
A. 只含有Na+ B. 一定含有Na+,可能含K+
C. 既含有Na+,又含K+ D. 可能含有Na+,可能含有K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如下装置进行实验①和②,在相同时间内,记录现象如下(溶液的温度变化均不明显)。
实验装置 | 实验序号 | 电极材料 | 实验现象 |
| ① | 铂 | 两极均产生大量无色气泡, 两极区的溶液均未见白色浑浊 |
② | 石墨 | 两极均产生大量无色气泡, 阴极区未见白色浑浊, 阳极区产生白色浑浊,分离出该白色固体,加酸溶解,产生气泡 |
根据实验现象,下列说法正确的是
A. ①②中,阴极的电极反应式:2H2O-4e == O2↑+ 4H+
B. ②中,白色浑浊的主要成分是Ca(OH)2
C. ②中,产生白色浑浊的主要原因是电解过程消耗水
D. ②中,产生白色浑浊与阳极材料被氧化生成CO32有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的用途与其性质的对应关系错误的是 ( )
A. 氯气用于自来水消毒— 次氯酸的强氧化性
B. 碘化银用于人工降雨— 使空气中水蒸汽凝聚
C. 氢氟酸腐蚀玻璃— 强酸性
D. 溴化银用于照相术— 光照分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO、CO2的应用对构建人类的生态文明建设有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为__________。
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH ![]() HCOOCH3 + 2H2
HCOOCH3 + 2H2
ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为________。
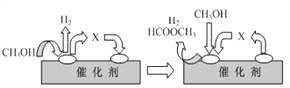
②写出ⅱ(分解)反应的化学方程式____________。
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
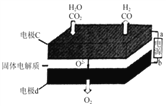
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:____________。
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:_________、_________。
(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。
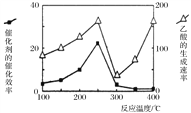
在250-300℃过程中影响速率的主要因素是___________;在300-400℃过程中影响速率的主要因素是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气处理装置中可发生反应:4CO+2NO2 ![]() 4CO2+N2,下列对该反应的说法正确的是
4CO2+N2,下列对该反应的说法正确的是
A. NO2被氧化 B. CO是氧化剂
C. 该条件下,氧化性CO2<NO2 D. 该条件下,还原性CO<N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com