
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向0.1 mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| B. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 | |
| D. | 0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
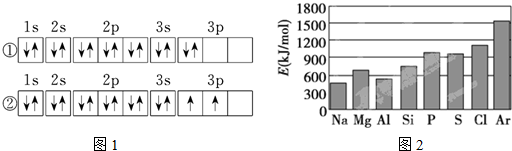
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | BrCl+H2O═HCl+HBrO | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com