
| A. |  将NO2球浸泡在冷水中和热水中 | |
| B. | 排饱和食盐水收集氯气 | |
| C. | 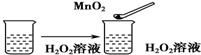 | |
| D. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3△H<0工业合成氨,通常选择高压的条件 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.存在平衡2NO2?N2O4,且正反应是放热反应,升高温度,平衡向逆反应方向移动,所以气体颜色加深,可以用平衡移动原理来解释,故A正确;
B.氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,抑制了氯气的溶解,所以用排饱和食盐水的方法收集氯气,可以用平衡移动原理来解释,故B正确;
C.过氧化氢分解,加入的二氧化锰起催化剂的作用,加快过氧化氢分解,不能用平衡移动原理解释,故C错误;
D.工业合成氨,正反应是气体体积缩小的反应,增大压强平衡正向移动,利于氨的合成,故D正确;
故选C.
点评 本题考查了平衡移动原理的使用对象,难度不大,注意使用平衡移动原理的前提必须是可逆反应.


科目:高中化学 来源: 题型:选择题
| A. | 第一电离能的大小:Mg>Al | |
| B. | 锗的第一电离能高于碳而电负性低于碳 | |
| C. | Ni是元素周期表中第28号元素,第2周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳 | |
| D. | 元素的第一电离能:Al<Si |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知甲、乙、丙、丁、戊是中学化学中常见的物质,常温下,戊是一种无色无味的液体,它们之间有如下反应关系.
已知甲、乙、丙、丁、戊是中学化学中常见的物质,常温下,戊是一种无色无味的液体,它们之间有如下反应关系.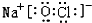 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
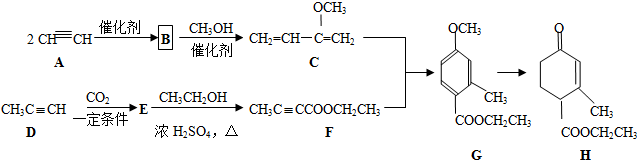
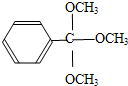 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应.甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体.请回答下列问题.
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应.甲是常见的黑色固体单质,乙是常见的气体单质,是空气的主要成分之一,B是无色气体,是主要的大气污染物之一,C常温下为无色液体,E是一种淡黄色的固体.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 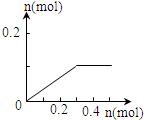 | B. | 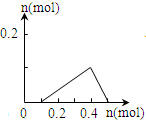 | C. | 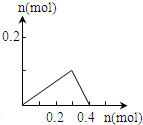 | D. | 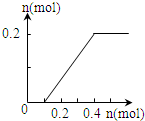 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | a>b>c | B. | a>c>b | C. | a=b+m+n | D. | a=c+n+m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③④ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml)[来 | 5 | 11 | 7 | 8[ | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com