
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示。

下列关于二氧化硅晶体的说法不正确的是( )
A. 晶体中每个硅原子与4个氧原子相连
B. 晶体中硅、氧原子个数比为1∶2
C. 晶体中最小环上的原子数为8
D. 晶体中共用一个硅原子的最小的环的原子数目为12
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列对相关实验的叙述符合事实的是
A.铁与水蒸气在高温下的反应产物为Fe3O4和H2
B.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中缓慢地加入一绿豆粒大的金属钠,可能观察到的现象是如图
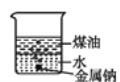
C.用洁净的铂丝蘸取待测液,置于酒精灯火焰上灼烧,观察到火焰呈黄色,则表明待测液中一定含有Na+而不含K+
D.用坩埚钳夹住铝箔在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用气体体积测量法
(1)把一定量样品与足量稀硫酸反应后,用如图装置测量产生CO2气体的体积,B溶液最好采用__________(以下选项中选择)使测量误差较小.

A.饱和碳酸钠溶液
B.饱和碳酸氢钠溶液
C.饱和氢氧化钠溶液
D.饱和盐酸溶液
方案Ⅱ:乙组同学的主要实验流程图如下:

按如下图所示装置进行实验:(已知:碱石灰中含有NaOH和CaO,能吸收水分和酸性气体)
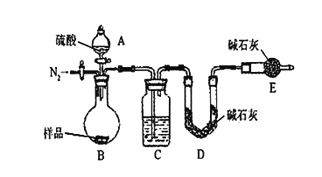
(2)在D中装碱石灰来吸收净化后的气体.E装置的作用是______________________.
(3)有的同学认为为了减少实验误差,在反应前后都通入N2,反应后通入N2的目的是_______________________________.
方案Ⅲ:丙组同学用质量法,按如下图所示的实验流程进行实验:

(4)实验时,蒸发结晶操作中,除了酒精灯外,还要用到的玻璃仪器是________
(5)有同学认为“加入适量盐酸”不好操控,应改为“过量盐酸”,便于操作且不影响测定的准确性,为什么__________________________________
(6)若实验中测得样品质量为46.4g,固体质量为40.95g,则碳酸钠的质量分数为_____.(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaC1晶体,相应的实验过程如下:
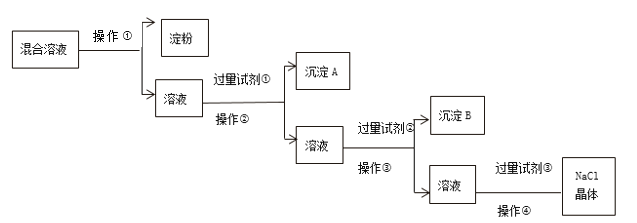
(1)操作①是利用胶体不能通过___________而把淀粉胶体和溶液进行分离。
(2)写出上述实验过程中所用试剂的化学式:试剂①____________;试剂③___________。
(3)判断试剂①已过量的操作是______________________。
(4)操作④的名称是____________。
(5)试剂的作用(用离子方程式表示):__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、( NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,现象和有关数据如图所示(气体体积数据换算成标准状况)。关于该固体混合物,下列说法正确的是( )

A.含有4.5gAl
B.不含FeCl2、AlCl3
C.含有物质的量相等的( NH4)2SO4和MgCl2
D.含有MgCl2、FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )
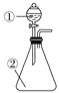
A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3g钠跟水反应后,得到100mL溶液,2Na+2H2O=2NaOH+H2↑
试计算:(1)生成的气体在标况下的体积是多少?___
(2)反应后所得溶液的物质的量浓度是多少?___
(3)在完全反应后转移的电子个数为多少?(用单线桥方法标出)___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
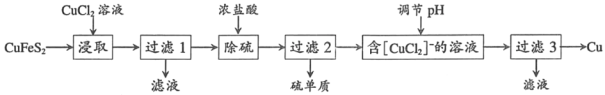
已知:CuFeS2+3CuCl2=4CuCl+FeCl2+2S
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_____.
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为_____.
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是_____.(填离子符号)
(4)过滤3所得滤液中可以循环使用的物质有_____,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为_____.
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2![]() 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2![]() 2Cu+SO2此工艺与前一工艺相比主要缺点有_____.
2Cu+SO2此工艺与前一工艺相比主要缺点有_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com