
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):分析 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1,而n=2,则A为N元素;E原子核外的M层中只有两对成对电子,外围电子排布为3s23p4,则E为S元素;化合物B2E为离子化合物,B表现+1价,原子序数大于碳、小于硫,则B为Na;C元素是地壳中含量最高的金属元素,则C为Al;D单质常用于制作太阳能电池和集成电路芯片,则D为Si;F原子最外层电子数与B的相同,其余各内层轨道均充满电子,原子序数大于硫,处于第四周期,核外电子数为2+8+18+1=19,则F为Cu,据此答题;
解答 解:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1,而n=2,则A为N元素;E原子核外的M层中只有两对成对电子,外围电子排布为3s23p4,则E为S元素;化合物B2E为离子化合物,B表现+1价,原子序数大于碳、小于硫,则B为Na;C元素是地壳中含量最高的金属元素,则C为Al;D单质常用于制作太阳能电池和集成电路芯片,则D为Si;F原子最外层电子数与B的相同,其余各内层轨道均充满电子,原子序数大于硫,处于第四周期,核外电子数为2+8+18+1=19,则F为Cu.
(1)N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,同周期随原子序数增大第一电离能呈增大趋势,同主族自上而下第一电离能减小,故第一电离能:Na<S<N,
故答案为:Na<S<N;
(2)氢化物N2H4分子N原子形成2个N-H键、1个N-N键,还含有1对孤对电子,故N原子采取sp2 杂化,
故答案为:sp2;
(3)按原子的外围电子排布分区,元素Cu在ds区,二价阳离子Cu2+与过量的氨气水溶液反应的离子方程式为:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O,
故答案为:ds;Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O;
(4)元素N和Al可形成一种新型化合物材料,其晶体具有很高的硬度和熔点,该化合物属于原子晶体,其化合物中所含的化学键类型为:共价键,
故答案为:共价键;
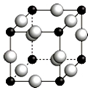
(5)A、F形成某种化合物的晶胞结构如图所示的立方晶胞(其中A显-3价,每个球均表示1个原子),
晶胞中小黑色球数目为8×$\frac{1}{8}$=1,大灰色球数目为12×$\frac{1}{4}$=3,其中N显-3价,则小黑色球为N原子、大灰色球为Cu,则其化学式为Cu3N;
设阿伏伽德罗常数为NA,晶胞质量为$\frac{64×3+14}{N{\;}_{A}}$g,距离最近的两个Cu原子的核间距为a cm,则晶胞棱长为$\frac{\sqrt{2}}{2}$acm×2=$\sqrt{2}$acm,
则该化合物的晶胞密度为:$\frac{\frac{64×3+14}{N{\;}_{A}}}{(\sqrt{2}a)^{3}}$g/cm3=$\frac{103\sqrt{2}}{2{a}^{3}{N}_{A}}$g/cm3,
故答案为:Cu3N;$\frac{103\sqrt{2}}{2{a}^{3}{N}_{A}}$.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,涉及核外电子排布、电离能、杂化方式、配合物、晶体类型与性质、晶胞计算等知识,明确原子结构与元素周期律、元素周期表的关系为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:d>b | |
| B. | 最高价氧化物对应水化物的酸性:d>c | |
| C. | 化合物ac2中含有离子键 | |
| D. | 氧元素分别与a、b形成的化合物都是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
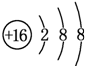 ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,电子式为 .
.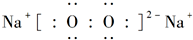 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用加热法分离NH4Cl和I2 | |
| C. | 用无水乙醇提取碘水中的单质碘 | |
| D. | 用饱和Na2CO3溶液鉴别乙酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
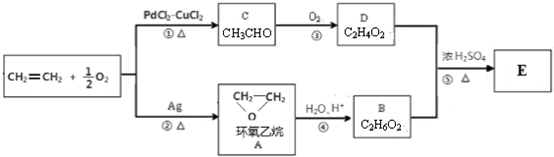
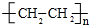 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=5的NH4Cl溶液与pH=5的硫酸中,水电离的c(H+)相同 | |
| C. | pH=9的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转化过程中,增大c(H+),平衡向正反应方向移动,CrO42-的转化率提高 | |
| B. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 | |
| C. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g | |
| D. | 常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸与NaOH溶液反应 | B. | KNO3加入水中 | ||
| C. | NH4NO3加入水中 | D. | CaO加入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
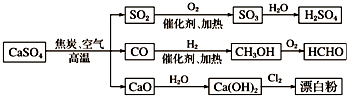
| A. | CO、SO2、SO3均是酸性氧化物 | |
| B. | 图示转化反应均为氧化还原反应 | |
| C. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| D. | 用CO合成CH3OH,原子利用率为100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com