
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| C. | NO2和N2O4 的混合气体中,NO2的体积分数是80% | |
| D. | 该合金中铜与镁的物质的量之比是2:1 |
分析 金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为:2.54g-1.52g=1.02g,氢氧根的物质的量为$\frac{1.02g}{17g/mol}$=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{2x+2y=0.06}\\{64x+24y=1.52}\end{array}\right.$,解得:x=0.02,y=0.01,
A.反应后溶质为硝酸钠,根据氮元素守恒计算硝酸钠的物质的量,根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=$\frac{n}{c}$计算需要氢氧化钠溶液的体积;
B.根据c=$\frac{1000ρω}{M}$计算该浓硝酸的物质的量浓度;
C.根据n=$\frac{V}{{V}_{m}}$计算NO2和N2O4混合气体的物质的量,设二氧化氮的物质的量为amol,根据电子转移列方程计算;
D.根据分析计算出合金中铜与镁的物质的量之比.
解答 解:金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为:2.54g-1.52g=1.02g,氢氧根的物质的量为$\frac{1.02g}{17g/mol}$=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{2x+2y=0.06}\\{64x+24y=1.52}\end{array}\right.$,解得:x=0.02,y=0.01,
A.反应后溶质为硝酸钠,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=0.64mol,故需要氢氧化钠溶液的体积为$\frac{0.64mol}{1mol/L}$=0.64L=640mL,故A错误;
B.该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,故B正确;
C.NO2和N2O4混合气体的物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,设二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,混合气体中NO2的体积分数是:$\frac{0.04mol}{0.05mol}$×100%=80%,故C正确;
D.关键分析可知,合金中铜与镁的物质的量之比是0.02mol:0.01mol=2:1,故D正确;
故选A.
点评 本题考查混合物的有关计算,题目难度中等,明确反应发生的实质为解答关键,注意根据守恒思想进行的解答,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10 | B. | C2H6O | C. | C3H8O | D. | C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
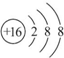 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在5 min内该反应用C表示的反应速率为0.02 mol•L-1•min-1 | |
| B. | 5 min时,容器内D的浓度为0.2 mol•L-1 | |
| C. | 当容器内压强保持恒定时,该可逆反应达到平衡状态 | |
| D. | 5 min时容器内气体总的物质的量为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、AlO2-、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水中滴加少量的小苏打溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O | |
| C. | 过氧化钠和水反应:2O22-+2H2O═4OH-+O2↑ | |
| D. | H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5 H2O2+6H+═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电泳 | B. | 过滤 | C. | 布朗运动 | D. | 丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com