
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol﹣l
C(s)+O2(g)=CO2(g) △H=﹣393.5kJmol﹣l
2C(s)+O 2(g)=2CO(g) △H=﹣221kJmol﹣l
若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式__________________________________________________________。
,请写出此反应的热化学方程式__________________________________________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g)。若在恒容绝热的密闭容器中充入一定量 N2O5进行该反应,下列选项能判断该反应达到平衡状态的是_______。
4NO2(g)+O2(g)。若在恒容绝热的密闭容器中充入一定量 N2O5进行该反应,下列选项能判断该反应达到平衡状态的是_______。
A.v 正(N2O5)=2v 逆(NO2) B.容器内NO2浓度是O2浓度的4倍
C.平衡常数K不再随时间而变化 D.混合气体的密度保持不变
E.混合气体的压强不随时间而变化
(3)工业上也可以利用I2O5消除CO的污染。已知:5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的4L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间变化的曲线如下图。回答下列问题:
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的4L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间变化的曲线如下图。回答下列问题:

①下列说法正确的是______________
A.d点时,增大体系压强,CO的转化率变大
B.T2时,0~2.0min内的反应速率v(CO)=0.6molL﹣lmin﹣l
C.b点时,向平衡体系中再加入I2O5(s),平衡向正反应方向移动
D.c点时体系中混合气体的压强在T2温度下更大
②5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)△H=_________0(填“>”、“=“、“<“),判断理由是______________________________________________。
5CO2(g)+I2(s)△H=_________0(填“>”、“=“、“<“),判断理由是______________________________________________。
(4)N2O4与 NO2之间存在反应:N2O4(g)![]() 2NO2(g)△H=QkJmol﹣l.将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如下图所示.如图 中 a 点对应温度下,已知 N2O4的起始压强 p0为 200kPa,该温度下反应的平衡常数的计算表达式Kp=______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2NO2(g)△H=QkJmol﹣l.将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如下图所示.如图 中 a 点对应温度下,已知 N2O4的起始压强 p0为 200kPa,该温度下反应的平衡常数的计算表达式Kp=______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=﹣746.5kJmolˉ1 CE D < 由图可知T2>T1,温度升高CO2体积分数减小,平衡逆向移动,升高温度,平衡向吸热的方向移动,正向为放热反应 213.3KPa
【解析】(1)若某反应的平衡常数表达式为:K=![]() ,则反应为:2NO(g)+2CO(g)N2(g)+2CO2(g)
,则反应为:2NO(g)+2CO(g)N2(g)+2CO2(g)
又①N2(g)+O2(g)=2NO(g)△H=+180.5kJmoll
②C(s)+O2(g)=CO2(g)△H=393.5kJmoll
③2C(s)+O2(g)=2CO(g)△H=221kJmoll
盖斯定律计算②×2③①得到2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=746.5kJmolˉ1,
故答案为:2NO(g)+2CO(g)N2(g)+2CO2(g)△H=746.5kJmolˉ1;
(2)A.N2O5与NO2的速率关系为:2v正(N2O5)=v逆(NO2),而不是v 正(N2O5)=2v 逆(NO2)A项错误;B. 容器内NO2浓度是O2浓度的4倍,不能确定反应是否达到化学平衡状态,B项错误;C. 平衡常数K仅与温度有关,所以平衡常数K不再随时间而变化,则说明温度不变,又恒容绝热,所以反应已达到化学平衡状态,C项正确;D. 反应前后质量不变,体积不变,所以混合气体的密度一直保持不变,则不能确定反应达到化学平衡状态,D项错误;E. 混合气体的压强不随时间而变化,反应已达到化学平衡状态,E项正确;故答案为:CE;
(3)①A. 对于给定的反应前后气体物质的量不变,增大压强平衡不移动,A项错误;B. 化学反应速率v=![]() =0.3molLlmin1,B项错误;C. 加入固体,平衡不移动,C项错误;D. 根据先拐先平衡知,T2比T1高,此时混合气体的压强更大,D项正确;答案选D;
=0.3molLlmin1,B项错误;C. 加入固体,平衡不移动,C项错误;D. 根据先拐先平衡知,T2比T1高,此时混合气体的压强更大,D项正确;答案选D;
②由图可知T2>T1,温度升高CO2体积分数减小,平衡逆向移动,升高温度,平衡向吸热的方向移动,正向为放热反应 ,故答案为:<;由图可知T2>T1,温度升高CO2体积分数减小,平衡逆向移动,升高温度,平衡向吸热的方向移动,正向为放热反应;
(4)四氧化二氮的转化率是0.4,设原来四氧化二的物质的量为xmol,转化的物质的量为0.8xmol,则混合气体的物质的量=(x0.4x+0.8x)mol=1.4xmol,相同条件下气体的压强之比等于其物质的量之比,所以反应后压强=200KPa![]() 1.4xmol=280xKPa,四氧化二氮的分压=
1.4xmol=280xKPa,四氧化二氮的分压=![]() =120KPa,二氧化氮的分压=
=120KPa,二氧化氮的分压=![]() =160KPa,化学平衡常数K=生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积=1602
=160KPa,化学平衡常数K=生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积=1602![]() 120=213.3KPa,故答案为:213.3KPa;
120=213.3KPa,故答案为:213.3KPa;


科目:高中化学 来源: 题型:
【题目】色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( ) 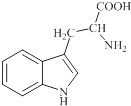
A.色氨酸的分子式为C11H12N2O2
B.色氨酸能发生取代、加成、酯化、中和反应
C.色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐
D.将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL浓度为0.1mol/L的CH3COOH溶液中逐滴加入0.1mol/L的NaOH溶液,溶液pH的变化如图所示,下列说法不正确的是( )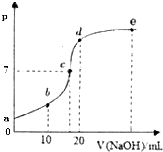
A.c点时,c(Na+)=c(CH3COO﹣)
B.b点时,c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
C.d点时,c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D.从a点到c点间可能有:c(CH3COO﹣)>c(H+)=c(Na+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产会产生大量CO2,增加了碳排放量。人们一直努力将CO2变废为宝。
途径一:将CO2催化加氢可制取乙烯。
已知:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) ΔH= -152kJ/mol
C2H4(g)+4H2O(g) ΔH= -152kJ/mol
(1)如图所示为在体积为2L的恒容容器中,投料为1mol CO2和3mol H2时,测得温度对CO2的平衡转化率和催化剂催化效率的影响。请回答:

①计算250℃时该反应的化学平衡常数K=_______(列出计算式即可)。
②下列说法正确的是_____。
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.当压强、混合气体的密度或![]() 不变时均可视为化学反应已达到平衡状态
不变时均可视为化学反应已达到平衡状态
d.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
(2)下列措施一定可以提高平衡体系中C2H4百分含量,又能加快反应速率的是 ________。
a.升高温度 b.缩小体积,增大压强
c.增大H2的浓度 d.将产物从反应体系中分离出来
途径二:以稀硫酸为电解质溶液,利用电解原理将CO2转化为乙烯。
已知:该电解池的工作原理如图所示。

(1)M极上的电极反应式为________________________;
(2)已知铅蓄电池放电时发生的反应为:PbO2+ Pb + 2H2SO4 = 2PbSO4 + 2H2O。若铅蓄电池中消耗1molH2SO4,理论上能产生标准状况下C2H4____________L(结果保留两位小数)。
(3)反应一段时间后,停止通电并撤掉交换膜使溶液充分混合。此时和电解前相比,硫酸溶液的pH____________(选填“变大”、“变小”或“不变” )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸是重要的医药和染料中间体,其应用非常广泛.扁桃酸的结构简式如图所示.
请回答:
(1)扁桃酸分子中含氧官能团的名称是 .
(2)扁桃酸的分子式是 .
(3)扁桃酸在一定条件下发生自身缩聚反应生成聚合物的化学方程式是
(4)扁桃酸有多种同分异构体,请写出任意一种满足下列条件的同分异构体的结构简式: .
①含酯基且能发生银镜反应
②羟基直接连在苯环上
③苯环上只有2个取代基.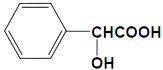
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空格处填上合适的答案。
(1)某烯烃与H2发生加成反应后得到的产物是CH3﹣CH(CH3)2 .
该产物的名称是;原来烯烃的结构简式为:;
(2)今有化合物: 
①请判别上述哪些化合物互为同分异构体: .
②请按酸性由强至弱排列甲、乙、丙的顺序:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是新型氢氧燃料电池,其电解质为固体氧化物电解质,则下列说法中不正确的是( )

A. 图2电池放电过程屮,O2-从B极区向A极区迁移
B. 图2电池负极区的电极反应为H2-2e-+O2-=H2O
C. 若用氯化钠和酚酞混合溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点处出现红色
D.若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则b接的是A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知1mol SO2(g)氧化为1mol SO3(g)的能量变化如图所示:反应过程
(1)由图可知该反应为(填“吸热”或“放热”)反应.
(2)该反应通常用V2O5作催化剂,加入V2O5会使图中E1(填“增大”、“减小”或“不变”),加入V2O5 后该反应的△H(填“增大”、“减小”或“不变”).
(3)已知,2H2S(g)+O2(g)═2S(s)+2H2O(g)△H=﹣442.4kJ/mol ①S(s)+O2(g)═SO2(g)△H=﹣297.0kJ/mol ②
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)韵热化学方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com