
| A、能与Cu反应产生气体的溶液:Na+、Fe2+、Cl-、SO42- |
| B、滴入甲基橙显红色的溶液:K+、Cu2+、NO3-、I- |
| C、由水电离出的C(H+)?C(OH-)═10-24溶液:K+、Na+、NO3-、Cl- |
| D、无色溶液:K+、Al3+、ClO-、SO42- |


科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| B | SO2有氧化性 | SO2尾气可用NaOH溶液吸收 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | NH3和HCl在水中溶解度很大 | 充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| B、在强酸溶液中:Na+、ClO-、Cl-、Ba2+ |
| C、在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- |
| D、由水电离的c(H+)=10-13mol?L-1的溶液中:Na+、Cl-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋、味精--调味品 |
| B、酒精、汽油--易燃液体 |
| C、Na+、Fe3+--人体所需微量元素 |
| D、废塑料瓶、铝制易拉罐--可回收垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恒容密闭容器中进行反应:2A2(g)+B2(g)?2A2B(g);△H<0,达到化学平衡后,加热会使逆反应速率大于正反应速率 |
| B、在常温下,用惰性电极电解饱和Na2CO3溶液,Na2CO3溶液的浓度不变 |
| C、使用催化剂能够改变反应历程,增大反应物分子的接触面积,从而加快反应速率 |
| D、放热或熵增过程自发进行的可能性比吸热或熵减过程要大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钙和氮均为人体所需的微量元素 |
| B、二氧化硅是太阳能电池的主要材料 |
| C、油脂和蛋白质均属于高分子化合物 |
| D、明矾与水作用能生成有吸附性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
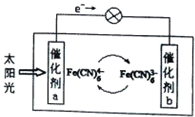 一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A、K+移向催化剂b |
| B、催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63- |
| C、Fe(CN)63-在催化剂b表面被氧化 |
| D、电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 解释或结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液,出现白色沉淀 | 溶液中一定含有SO42- |
| B | 将某气体通入品红溶液褪色,加热又变红 | 气体为SO2 |
| C | 将气体通过饱和Na2CO3溶液 | 除去CO2中的HCl |
| D | 配制FeSO4溶液时,应加入过量铁粉和稀硫酸 | 溶液中不断产生FeSO4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com