
分析 (1)质量相同时,分子中H元素的质量分数越小,完全燃烧时消耗O2越少;
(2)根据混合气体的密度是相同状况下H2密度的12.5倍可以确定有机物的平均摩尔质量25g/mol,故混合气体中一定有甲烷,混合气体的总的物质的量为:$\frac{10g}{25g/mol}$=0.4mol;该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以甲烷的质量为1.6g,物质的量为0.1mol,故烯烃的物质的量为0.3mol,结合烯烃的质量和物质的量来确定烯烃的摩尔质量,再根据烯烃组成通式确定烯烃;
(3)据氧气过量,烃的燃烧通式CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,在常温下水的状态为液态,则反应后残留的气体为二氧化碳、氧气,然后根据体积差列式计算出y值,最后根据各烃的组成通式写出烃的分子式;混合气体平均相对分子质量为22.4L/mol×1.12g.L-1=25.088g,再根据混合气体10ml,列出两个等式求烃的体积.
解答 解:(1)CH4、C2H4、C3H6、C2H2的H%大小为:CH4>C3H6=C2H4>C2H2,质量相同时,分子中H元素的质量分数越小,完全燃烧时消耗O2越少,故完全燃烧时消耗O2的量最少的是C2H2,
故答案为:C2H2;
(2)混合气体的密度是相同状况下H2密度的12.5倍,所以混合物的平均摩尔质量为12.5×2g/mol=25g•mol-1,所以混合气体中一定有甲烷,混合气体的总的物质的量为$\frac{10g}{25g/mol}$=0.4mol,该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以甲烷的质量为10g-8.4g=1.6g,甲烷的物质的量为$\frac{1.6g}{16g/mol}$=0.1mol,故烯烃的物质的量为0.4mol-0.1mol=0.3mol,所以M(烯烃)=$\frac{8.4g}{0.3mol}$=28g•mol-1,设烯烃的组成为CnH2n,则:14n=28,解得:n=2,故该烯烃为乙烯,所以该混合物为甲烷,乙烯,
故答案为:甲烷;乙烯;
(3)常温下水的状态为液体,氧气过量,残留气体为二氧化碳和氧气的混合物,则:
CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O~△n=1+$\frac{y}{4}$
1mol ( 1+$\frac{y}{4}$)mol
10ml (50+10-40)ml
$\frac{1mol}{10ml}$=$\frac{(1+\frac{y}{4})mol}{(50+10-40)ml}$,解得y=4,故烷烃为CH4,烯烃为C2H4,
设CH4,C2H4,分别为xml,yml,
则x+y=10①,混合气体平均相对分子质量为22.4L/mol×1.12g.L-1=25.088g,则$\frac{16×\frac{x}{22400}+28×\frac{y}{22400}}{\frac{x}{22400}+\frac{y}{22400}}=25.088$②,联立①②解得x=2.43ml,y=7.57ml,
故答案为:CH4;C2H4;2.43ml;7.57ml.
点评 本题考查有机物分子式的确定方法,难度中等,注意利用燃烧通式及体积差量法解答.


科目:高中化学 来源: 题型:选择题
| A. | 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| D. | 陶瓷是人类应用很早的硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | ||||||||||||||||||
| g | j | |||||||||||||||||
| b | c | f | i | l | m | |||||||||||||
| e | h | k | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )
氢气是一种清洁对可再生能源.某氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约是( )| A. | 100mol | B. | 250mol | C. | 500mol | D. | 1000 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验1 | 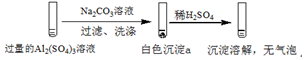 |
| 实验2 | 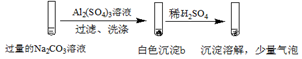 |
| A. | 实验1中,白色沉淀a是Al(OH)3 | |
| B. | 实验2中,白色沉淀b含有CO32- | |
| C. | 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关 | |
| D. | 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将CO2通入CaCl2溶液中 | 产生白色沉淀 | CaCO3难溶于水 |
| B | 向某溶液滴加少量稀盐酸 | 溶液中出现白色沉淀 | 该溶液中一定存在Ag+ |
| C | 向AgCl沉淀中滴加NaBr溶液 | 白色沉淀转化为浅黄色沉淀 | Ksp(AgCl)>Ksp(AgBr) |
| D | 将苯滴加到溴水中 | 溴水褪色 | 苯和溴发生了取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | Cu(OH)2固体与稀硫酸反应:OH-+H+═H2O | |
| D. | 铝片与NaOH溶液反应:Al+OH-+H2O═AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 二氧化硅可以和NaOH溶液及HF溶液反应 | 二氧化硅属于两性氧化物 |
| B | SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑ | 酸性:H2SiO3>H2CO3 |
| C | 向氯化铝溶液中滴加氢氧化钠溶液,观察到先产生白色沉淀后沉淀溶解 | 氢氧化铝可溶于强碱 |
| D | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝的熔点髙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com