
【题目】电-Fenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2![]() Fe3++OH- +·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法不正确的是
Fe3++OH- +·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法不正确的是

A.电源的A极是负极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O-e-![]() ·OH + H+
·OH + H+
D.消耗1molO2,可以产生4mol ·OH
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=___kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=___kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有___。
A.使用过量的CO B.升高温度 C.增大压强
(3)以下说法能说明反应3H2(g)+3CO(g) ![]() CH3OCH3(g)+CO2(g) 达到平衡状态的有______。
CH3OCH3(g)+CO2(g) 达到平衡状态的有______。
A.H2和CO2的浓度之比为3:1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应: C(s)+CO2(g) ![]() 2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。
①该反应H_____0(填“>”、“<”或“=”),550℃时,平衡后若充入惰性气体,平衡_____(填“正移”、“逆移“或“不移动" )。
②)650℃时,反应达平衡后CO2的转化率为_____(保留2位有效数字)。
③T℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=_____P总.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁山(在今河北省邯郸市武安)是我国四大发明之一指南针的发源地。据《古矿录》记载:《明史地理志》称:“磁州武安县西南有磁山,产磁铁石。”文中的磁铁石的主要化学成分应该是( )
A.Fe2O3B.FeOC.Fe3O4D.Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 常温下,100g 46%乙醇水溶液中含有H原子数为12 NA
B. 23g Na与足量O2反应,生成Na2O 和Na2O2 的混合物,转移的电子数为 NA
C. 标准状况下,2.24 LCCl4 含有的共价键数为0.4 NA
D. 1 molN2与4molH2反应生成的NH3分子数小于2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】括号内物质为杂质,下列除去杂质的方法不正确的是
A. 乙酸乙酯(乙酸):用NaOH溶液洗涤后分液 B. 乙烷(乙烯):用溴水洗气
C. 溴苯(溴):用NaOH溶液洗涤后分液 D. 乙醇(水):用生石灰吸水后蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关金属腐蚀的论述,正确的是
A.金属的腐蚀一定伴有电流产生
B.Fe在干燥的氯气里比在潮湿的空气里更易被腐蚀
C.发生化学能转变为电能的腐蚀时较活泼的金属总是作正极而被腐蚀
D.发生电化学腐蚀时都有能量的转变,且被腐蚀的金属总是失电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

关于该固体混合物,下列说法正确的是
A. 一定含有Al,其质量为4.5g
B. 一定不含FeCl2,可能含有MgCl2和AlCl3
C. 一定含有MgCl2和FeCl2
D. 一定含有(NH4)2SO4和MgCl2,且物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. 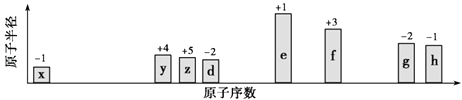
根据判断出的元素回答问题:
(1)y在周期表中的位置是 .
(2)比较d、e常见离子的半径大小(用化学式表示,下同):;比较g、h的最高价氧化物对应水化物的酸性强弱 .
(3)任选上述元素组成2种四原子共价化合物,写出其电子式:; .
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com