
分析 (1)氯气具有强氧化性,向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明生成I2,继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明I2被进一步氧化,生成HIO3,同时氯气被还原为HCl,则碘元素化合价变化为:0→+5,氯气中氯元素化合价变化为:0→-1,依据得失电子守恒、原子个数守恒配平方程式;
(2)根据化合价变化判断氧化剂和还原剂;
(3)判断反应中氧化性强弱,可根据化学方程式判断:氧化剂+还原剂═还原产物+氧化产物;氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物来分析.
解答 解:①氯气具有强氧化性,向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明生成I2,继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明I2被进一步氧化,生成HIO3,同时氯气被还原为HCl,则碘元素化合价变化为:0→+5,氯气中氯元素化合价变化为:0→-1,1mol碘单质反应失去10mol电子,1mol氯气反应得到2mol电子,二者最小公倍数为10,依据氧化还原反应得失电子守恒,则氯气系数为5,碘单质系数为1,依据原子个数守恒,方程式:I2+5Cl2+6H2O=2HIO3+10HCl;
故答案为:I2、5Cl2、6H2O、2HIO3、10HCl;
(2)在2KI+Cl2=2KCl+I2反应,I元素的化合价升高,被氧化,KI在反应中做还原剂,在5Cl2+I2+6H20=2HIO3+10HCl反应,I元素的化合价升高,被氧化,I2在反应中做还原剂.
故答案为:KI、I2;
(3)氯气的氧化性比溴强,将KI换成KBr,则生成Br2,则CCl4层变为棕色,继续滴加氯水,CCl4层的颜色没有变化,说明氧化性HBrO3>Cl2,根据氧化剂和还原剂反应生成氧化产物和还原产物,氧化剂氧化性大于氧化产物的氧化性,
则有Cl2>HIO3,所以氧化性顺序为HBrO3>Cl2>HIO3,
故答案为:棕;HBrO3>Cl2>HIO3.
点评 本考查氧化还原反应的配平、氧化剂和还原剂、氧化性强弱的判断、化学计算知识.此题解答中用到了守恒法,守恒定律是自然界最重要的基本定律,是化学科学的基础.在化学反应中,守恒包括原子守恒、电荷守恒、得失电子守恒等.比如此题中我们就牢牢抓住了守恒,简化了计算过程,顺利解答.


科目:高中化学 来源: 题型:解答题
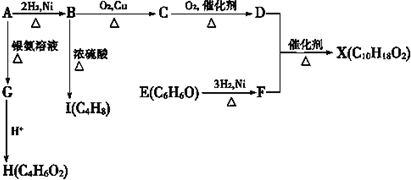
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
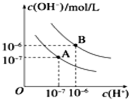 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
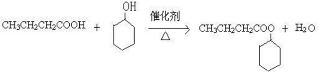
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸后,再做银镜反应实验或与新制Cu(OH)2共热的实验 | |
| C. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入稀硝酸酸化,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ④
④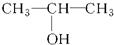 ⑤
⑤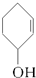 ⑥
⑥
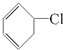 ⑧
⑧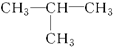 ⑨CH3-CH═CH2⑩
⑨CH3-CH═CH2⑩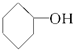 ⑪
⑪ ⑫CH3Cl
⑫CH3Cl查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2- Na+Mg2+Al3+ | B. | O Cl S P | ||
| C. | K+ Mg2+ Al3+ H+ | D. | A l3+Mg2+ Ca2+ F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子的能量越低,运动区域离核越远 | |
| B. | 当M层是最外层时,最多可排布18个电子 | |
| C. | 稀有气体元素原子的最外层都排有8个电子 | |
| D. | 核外电子的分层排布即是核外电子的分层运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
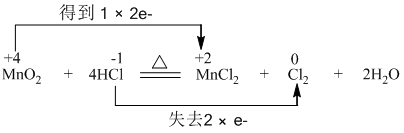
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com