
表示下列反应的离子方程式,正确的是
A.碱性高锰酸钾溶液与草酸氢钾反应:2MnO4-+HC2O4-+2H2O=2MnO42-+2CO32-+5H+
B.用稀醋酸检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+=Ca2++CO2↑+H2O
C.在苯酚钠溶液中通入少量CO2: C6H5O—+H2O+CO2= C6H5OH+HCO3—
D.制备氢氧化铁胶体:Fe3++3H2O == Fe(OH)3+3H+
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡 | 溶液出现棕黄色 | 2IO3-+5HSO3-═I2+5SO42-+3H++H2O 2IO3-+5HSO3-═I2+5SO42-+3H++H2O |
| 3. 再向上述溶液中滴加淀粉溶液,振荡 再向上述溶液中滴加淀粉溶液,振荡 |
溶液变成蓝色 | 淀粉遇碘变蓝 淀粉遇碘变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢气是一种清洁能源,可以通过多种方法制得.
氢气是一种清洁能源,可以通过多种方法制得.| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2) |
| c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡. | 溶液出现棕黄色 | 2IO3-+5HSO3-═I2+5SO42-+3H++H2O 2IO3-+5HSO3-═I2+5SO42-+3H++H2O |
| 3.再向上述溶液中滴加淀粉溶液,振荡. | 溶液变成蓝色 | 淀粉遇碘变蓝 淀粉遇碘变蓝 |
| ||
查看答案和解析>>
科目:高中化学 来源:2012届北京市朝阳区高三上学期期中考试化学试卷 题型:填空题
(13分)氢气是一种清洁能源,可以通过多种方法制得。
(1) 工业上用水煤气法制氢气,有关化学方程式是:
反应一:C( s) + H2O(g)
s) + H2O(g)  CO(g) + H2(g) △H> 0
CO(g) + H2(g) △H> 0
反应二:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
①若反应一在t℃时达到化学平衡状态,则此温度下该反应的的平衡常数表达式
K = ;
②在427℃时将CO 和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状态,该反应的平衡常数是9,则CO的转化率是 ,用CO的浓度变化表示的反应率速v(CO)是 mol /(L·min)。
(2)利用电解饱和食盐水也可制得氢气,下图为电解食盐水的示意图: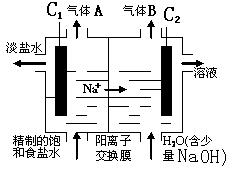
请回答:
① C1电极是 极(填“阴”或“阳”),C2电极的电极反应式是 。
②该电解反应的离子方程式是 ,
(3)通过下列方法也可以得到氢气。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
1molCH4(g)与H2O(g)反应生成CO2(g)和H2(g)的反应热是 kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省南阳市五校联谊高三上学期期中考试化学试卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置_______________________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)___________.
(3)由A、B、C三种元素以原子个数比4 :2 :3形成化合物X,X中所含化学键类型有________________.
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:____________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com