
| 物质 编号 |
物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① | 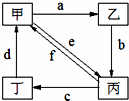 |
Cu | CuO | CuSO4 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | CH3CH2Cl | C2H5OH | CH2=CH2 | CH3CH3 |
| A、①②③④ | B、①②③ |
| C、①③④ | D、②④ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150mL 3mol?L-1 NaCl溶液 |
| B、75mL 2mol?L-1 NaNO3溶液 |
| C、150mL 2mol?L-1 Na2SO4溶液 |
| D、75mL 1mol?L-1的Na2S溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L乙醇中含有的碳原子数目为2NA |
| B、1mol CnH2n含有的共同电子对数为(3n+1)NA |
| C、1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA |
| D、1mol/L的FeCl3溶液中,所含Fe3+的数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是查看答案和解析>>
科目:高中化学 来源: 题型:
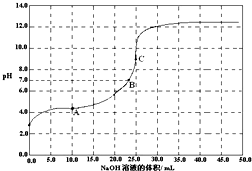 常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000mol/L某一元酸HX,滴定过程中pH 变化曲线如图所示.下列说法正确的是( )
常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000mol/L某一元酸HX,滴定过程中pH 变化曲线如图所示.下列说法正确的是( )| A、滴定前,酸中c(H+) 等于碱中c(OH-) |
| B、在A点,c(Na+)>c(X-)>c(HX)>c(H+)>c(OH-) |
| C、在B点,两者恰好完全反应 |
| D、在C点,c(X-)+c(HX)=0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 |
| B、密度:CCl4>CHCl3>H2O>苯 |
| C、同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷 |
| D、同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

c(HC
| ||
c(C
|
| O | - 3 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、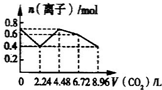 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com