
科目:高中化学 来源: 题型:
对铜—锌—稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是①锌片溶解了32.5克 ②锌片增重了32.5克 ③铜片上析出1克氢气④铜片上析出1mol氢气
A. ①③ B.①④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向A→导线→C。根据上述情况,回答下列问题:
(1)在①中,金属片 发生氧化反应;
(2)在②中,金属片 作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片 上有气泡产生;
(4)上述四种金属的活动性顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
医用氯化钙可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—103.0%),工艺流程为:
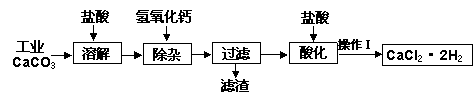
生产二水合氯化钙的主要流程
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:① ,
②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 (只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因
之一为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成 两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成 两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
A.原混合液中NO3-的物质的量为0.2mol
B.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气
C.溶液中最终溶质为FeSO4
D.c(H2SO4)为5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数, 下列说法正确的是( )
A. 常温常压下,0.1NA个HCl分子的体积为2.24L
B. 标准状况下,22.4L 氖气含有2NA 个原子
C. 1L 0.2mol/L 硫酸铁溶液中含有的SO42- 离子数目为0.2 NA
D. 1 mol氖中含有的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
A.1 mol O2 的质量为 32 g/mol
B.SO42-的摩尔质量是 96 g/mol
C.1mol任何物质的质量等于该物质的相对分子质量
D.二氧化碳的摩尔质量是 44 g
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:① 1molH2分子中化学键断裂时需要吸收436kJ的能量、② 1molCl2分子中化学键断裂时需要吸收243kJ的能量、③ 由H原子和Cl原子形成1molHCl分子时释放431kJ的能量。下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)===2HCl(g)
B.氢气与氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气与氯气反应生成2mol氯化氢气体,反应的△H=—183kJ/mol
D.氢气与氯气反应生成1mol氯化氢气体,反应的△H=—183kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com