
| A. | M、N、Q三种物质的浓度一定相等 | B. | M、N全部变成了Q | ||
| C. | 反应物和生成物的浓度都保持不变 | D. | 正反应和逆反应不再进行 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、当反应达到平衡状态时,M、N、Q三种物质的浓度不变,而不一定相等,故A错误;
B、可逆反应是反应物和生成物共存的体系,所以M、N不可能全部变成了Q,故B错误;
C、当体系达平衡状态时,各组分的浓度保持不变,说明正逆反应速率相等,达平衡状态,故C正确;
D、化学平衡状态是动态平衡,正反应和逆反应仍在进行,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ②③⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
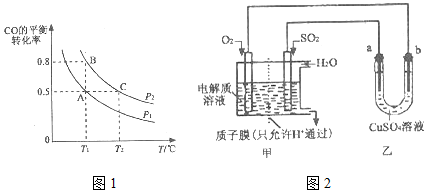
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
| 1 | 7.24 | 50.00 | 1.792 |
| 2 | 14.48 | 50.00 | 3.584 |
| 3 | 21.72 | 50.00 | 4.032 |
| 4 | 36.20 | 50.00 | 2.240 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当镀层都被破坏时,镀锌铁比镀锡铁更易被锈蚀 | |
| B. | 钢铁发生析氢腐蚀时和吸氧腐蚀时负极反应均是Fe-2e-=Fe2+ | |
| C. | 钢铁闸门上装上锌块是利用牺牲阳极的阴极保护法来防止其被腐蚀 | |
| D. | 钢管与电源负极连接是利用外加电流的阴极保护法来防止其被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①属于非氧化还原反应 | |
| B. | 反应②是水解反应 | |
| C. | 反应④中二氧化钛是氧化剂 | |
| D. | 反应⑤表现了金属镁还原性比金属钛强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com