
分析 2min后达到平衡,测得NH3的物质的量为4mol,则
4NH3+5O2$?_{加热}^{催化剂}$4NO+6H2O(g)
开始 5 7.25 0 0
转化 1 1.25 1 1.5
平衡 4 6 1 1.5
结合v=$\frac{△c}{△t}$、c=$\frac{n}{V}$、K为生成物浓度幂之积与反应物浓度幂之积的比.
解答 解:2min后达到平衡,测得NH3的物质的量为4mol,则
4NH3+5O2$?_{加热}^{催化剂}$4NO+6H2O(g)
开始 5 7.25 0 0
转化 1 1.25 1 1.5
平衡 4 6 1 1.5
(1)生成H2O(g)的物质的量为1.5mol,以NO的浓度变化表示该反应的平均反应速率是$\frac{\frac{1mol}{2L}}{2min}$=0.25mol/(L•min),
故答案为:1.5mol;0.25mol/(L•min);
(2)O2的平衡浓度是$\frac{6mol}{2L}$=3mol/L,
故答案为:3mol/L;
(3)NH3的转化率为$\frac{1mol}{5mol}$×100%=20%,
故答案为:20%;
(4)K为生成物浓度幂之积与反应物浓度幂之积的比,则K=$\frac{{c}^{4}(NO){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3}){c}^{5}({O}_{2})}$,故答案为:K=$\frac{{c}^{4}(NO){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3}){c}^{5}({O}_{2})}$.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率和速率计算等为解答的关键,侧重分析与计算能力的考查,注意K的表达式及意义,题目难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L水中含有6.02×1023个水分子 | |
| B. | 32 g氧气所含的原子数目为2×6.02×1023 | |
| C. | 常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L | |
| D. | 1 molCaCl2溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.
利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C2H4O2的有机物不一定有酸性 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 等质量的Al分别按a、b两种途径完全转化,途径a比途径b产生的H2多 途径a:Al$\stackrel{HCl}{→}$H2 途径b:Al$\stackrel{Fe_{2}O_{3}}{→}$Fe$\stackrel{HCl}{→}$H2 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
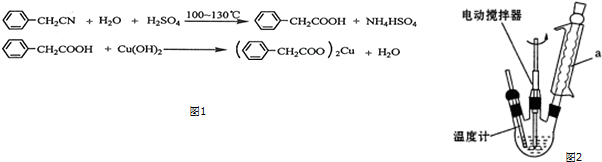
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
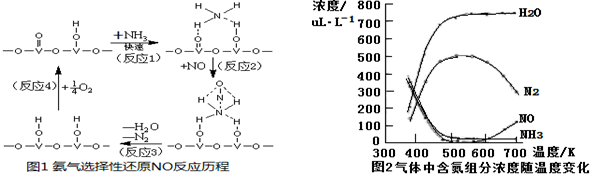
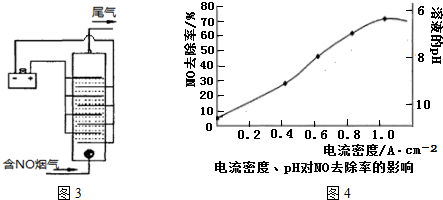
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | H-H | C-O |  | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A. | 反应在t1min末的速率为v(H2)=0.2/t mol•L-1•min-1 | |
| B. | 平衡时水蒸气的转化率为66.67% | |
| C. | 该温度下反应的平衡常数为l | |
| D. | 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时水蒸气的转化率为33.33% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com