
【题目】完成下列填空
(1)决定物质体积的因素:①构成物质的粒子数;②粒子大小;③粒子间的距离。对固体、液体物质而言,它主要是由上述________(填写编号,下同)决定;对气体物质而言,它主要由上述____________决定。
(2)标准状况下,体积为11.2 L的CO2的质量________g,其所含原子的总数是________个。
(3)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为________mol。
②该气体在标准状况下的体积为________ L。
【答案】①② ①③ 22 1.5NA ![]()
![]()
【解析】
(1)对固体、液体物质而言,粒子大小远远大于粒子间的距离,可以忽略粒子间的距离;而对气体物质而言,粒子间的距离远远大于粒子大小,可以忽略粒子大小,相同物质粒子数目越大,占有的体积越大;
(2)根据n=V/Vm计算二氧化碳的物质的量,再根据m=nM计算其质量,由N=nNA结合物质的组成计算;
(3)依据n=m/M=N/NA=V/Vm计算解答。
(1)相同物质粒子数目越大,占有的体积越大。对固体、液体物质而言,粒子大小远远大于粒子间的距离,可以忽略粒子间的距离,故构成物质的粒子数及粒子大小决定固体、液体的体积,答案选①②;而对气体物质而言,粒子间的距离远远大于粒子大小,可以忽略粒子大小,故构成物质的粒子数、粒子间的距离决定气体体积大小,答案选①③;
(2)标况下,11.2L二氧化碳的物质的量为:11.2L÷22.4L/mol=0.5mol,其质量为0.5mol×44g/mol=22g,则含有原子数为N=nNA=3×0.5×NA=1.5NA;
(3)①mg该气体的物质的量为:mg÷Mg/mol=![]() ;
;
②标况下气体摩尔体积Vm=22.4L/mol,该气体在标准状况下的体积为:22.4L/mol×![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】1949年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。臭氧能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图:呈V形,键角116.5°。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子提供1个电子,构成一个特殊的化学键(虚线内部分)——三个O原子均等的享有着4个电子。请回答:
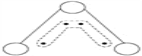
(1)题中非极性共价键是__键,特殊的化学键是 键。
(2)臭氧与氧气是_____。
(3)下列物质的分子与O3分子的结构最相似的是_______。
A.H2O B.CO2 C.SO2 D.BeCl2
(4)子中某一原子有1对没有跟其他原子共用的电子叫孤电子对,那么 O3分子有___对孤电子对。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
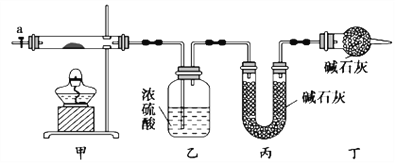
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_______________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_______(填字母)连接在__________(填装置连接位置)。
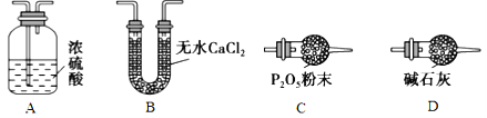
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______________。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
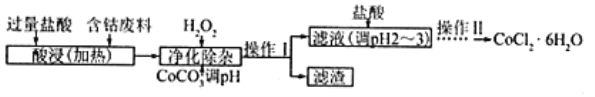
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2发生反应的离子方程式为_____________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________________。
③加盐酸调整pH为2~3的目的为_________________。
④操作Ⅱ过程为_______________(填操作名称)、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“胃舒平”的主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。下列叙述中错误的是( )
A. 镁元素基态原子的核外电子排布式是:1s22s22p63s2
B. 铝元素原子核外共有5种不同运动状态的电子
C. 钠元素离子半径比铝离子半径大
D. 金属铝与钠的最高价氧化物的水化物溶液发生反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑
【答案】B
【解析】试题分析:A.镁元素基态原子的核外电子排布式是:1s22s22p63s2,A正确;B.铝元素原子核外共有13种不同运动状态的电子,B错误;C.钠元素离子半径比铝离子半径大,C正确;D.金属铝与钠的最高价氧化物的水化物溶液发生反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑,D正确,答案选B。
考点:考查核外电子排布、微粒半径等有关判断
【题型】单选题
【结束】
17
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
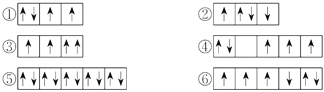
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下。
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
|
|
|
是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是 (填名称)。
(2)B元素在周期表中的位置为 。
(3)上述元素的原子M层有一个未成对p电子的是 (填元素符号)。
(4)丙的电子式为 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为 。
【答案】(1)氢(2)第2周期ⅣA族(3)Cl
(4) HClO+H2O+SO2=H2SO4+HCl
HClO+H2O+SO2=H2SO4+HCl
【解析】试题分析:四种短周期元素A、B、C、D,四种元素之间形成甲、乙、丙三种分子,由信息②,甲分子为V型结构,是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,故甲为水,乙为正四面体结构,无色无味而易燃,是21世纪的主要能源,乙为甲烷,丙分子有3个不同的原子,至少还有C、H、O中的两种,且有强氧化性,可以用于消毒杀菌,丙应是HClO,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为C元素、C为O元素、D为H元素,据此答题.
解:四种短周期元素A、B、C、D,四种元素之间形成甲、乙、丙三种分子,由信息②,甲分子为V型结构,是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,故甲为水,乙为正四面体结构,无色无味而易燃,是21世纪的主要能源,乙为甲烷,丙分子有3个不同的原子,至少还有C、H、O中的两种,且有强氧化性,可以用于消毒杀菌,丙应是HClO,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为C元素、C为O元素、D为H元素,
(1)根据上面的分析可知,甲、乙、丙中含有共同元素是氢元素,
故答案为:氢;
(2)B为碳元素,在周期表中第二周期第IVA族,
故答案为:第二周期第IVA族;
(3)上述元素的原子M层有一个未成对p电子的是氯元素,
故答案为:Cl;
(4)丙为次氯酸,它的电子式为![]() ,次氯酸与SO2水溶液可发生氧化还原反应,生成两种强酸,反应方程式为HClO+H2O+SO2=H2SO4+HCl,
,次氯酸与SO2水溶液可发生氧化还原反应,生成两种强酸,反应方程式为HClO+H2O+SO2=H2SO4+HCl,
故答案为:![]() ;HClO+H2O+SO2=H2SO4+HCl.
;HClO+H2O+SO2=H2SO4+HCl.
【题型】推断题
【结束】
19
【题目】现有部分前36号元素的性质或原子结构如下表
| 元素编号 | 元素性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X | |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是________________________________________________________。
(2)S元素的化合价是否有正价?__________,原因是__________________________________,最外层电子排布式为________________________。
(3)T元素的原子N能层上电子数为__________,其原子结构示意图为__________。
(4)X的核外电子排布图违背了__________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,钼酸钠(Na2MoO4)是一种无公害型冷却水系统的金属缓蚀剂。以钼精矿(主要成分为MoS2)为原料制备金属钼和钼酸钠晶体的主要流程如图所示。
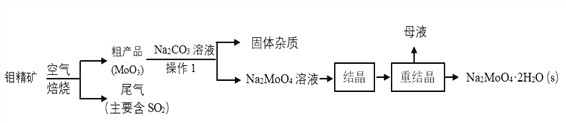
(1)Na2MoO4·2H2O 中钼元素的化合价为____________;
(2)在焙烧反应中,每生成1mol MoO3时转移电子数为:_______ (以NA表示阿伏加德罗常数的值);
(3)操作1中,粗产品中的MoO3与Na2CO3溶液充分反应后,生成Na2MoO4和另外一种物质,该物质的电子式为_____;
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______________________________________;
(5)结晶操作前需加入Ba(OH)2固体以除去溶液中的SO42-,SO42-的最大去除率是_____(结果保留一位小数)[已知:碱浸液中c(MoO42-)=0.80mol·L-1,(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.0×10-10,Ksp(BaMoO4)=4.0×10-8,Ba(OH)2引起的溶液体积变化忽略。]
(6)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:
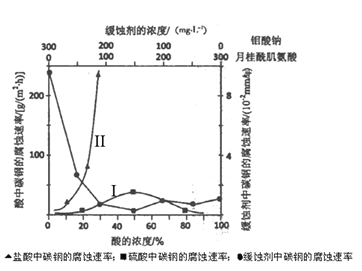
①试分析I、II曲线变化趋势不同的原因________________________________________
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_________________________________________________。
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出了五种元素的相关信息,其中X、Y、Z、W为短周期元素。
元素 | 相关信息 |
X | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
Y | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
Z | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
W | 室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
M | 它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、楼房等 |
根据上述信息填空:
(1)Y元素的基态原子含有几个能层:________,其中第二能层中有哪几个能级:________;画出W的原子结构示意图:________。
(2)Z与X形成的某一化合物能和Z与Y形成的另一无色化合物(这两种化合物分子中原子个数比皆为1:2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式:_______。
(3)某矿藏主要含W、M两种元素组成的化合物,它是我国生产某强酸的主要原料。试写出该生产过程中第一阶段主要反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)化合物 Mg5Al3(OH)19(H2O)4 可作环保型阻燃材料,受热时按如下化学方程式分解:2 Mg5Al3(OH)19(H2O)4 = 27H2O↑+10MgO+3A12O3
①写出该化合物作阻燃剂的依据_____
②用离子方程式表示除去固体产物中 A12O3 的原理_____。
(2)镁燃烧不能用 CO2 灭火,用化学方程式表示其理由_____。
(3)铝的亲氧性,可表现在铝能夺取化合物中的氧,例如 2Al+Fe2O3=Al2O3+2Fe。且反应放出大量的热,在冶金学上称为铝热反应。取少量铝热反应所得的固体混合物,将其溶于足量稀硫酸,滴加KSCN 溶液无明显现象,_____(填“能”或“不能”)说明固体混合物中无 Fe2O3,理由是_____、_____(用离子方程式说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com