
����Ŀ��ij��Һֻ���ܺ���K����Al3����Fe3����Mg2����Ba2����NH![]() ��Cl����SO
��Cl����SO![]() �е����������ӡ�ijͬѧȡ100 mL����Һ�ֳ����ȷݽ�������ʵ�飺
�е����������ӡ�ijͬѧȡ100 mL����Һ�ֳ����ȷݽ�������ʵ�飺
�ٵ�һ�ݼӹ���������������Һ����ȣ��ռ���0.02 mol�����壬����������ͬʱ�õ���Һ�ס�
������Һ����ͨ������Ķ�����̼���壬���ɰ�ɫ���������������ˣ�ϴ�����պõ�1.02 g���塣
�۵ڶ��ݼ��������Ȼ�����Һ�����ɰ�ɫ������������������ϴ�ӣ�����õ�11.65 g���塣�ݴˣ���ͬѧ�õ��Ľ�����ȷ����(�� ��)
A. ʵ����в���������Ϊ���������ɵ�ԭ��Һ��c(NH![]() )��0.2 mol��L��1
)��0.2 mol��L��1
B. ʵ����еİ�ɫ������һ����BaSO4�����ɵ�ԭ��Һ��n(SO![]() )��0.5 mol
)��0.5 mol
C. ԭ��Һ��һ����K������c(K��) ��0.4 mol��L��1
D. ��Ҫ�ж�ԭ��Һ���Ƿ���Cl���������������ʵ����֤
���𰸡�C
���������ٵ�һ�ݼӹ���NaOH��Һ����ȣ��ռ���0.02mol���壬��Ϊ������һ������NH4+�����ʵ���Ϊ0.02mol��Ũ��Ϊ0.02mol��0.05L=0.4mol/L���������ɣ���һ��������Fe3+��Mg2+���������Һ��ͨ�����CO2�����ɰ�ɫ��������Ϊ������������ԭ��Һ��һ����Al3+��һ��������̼������ӣ������Ӻ������������Ʒ�Ӧ����ƫ��������Һ����Һ��ͨ�����CO2�����ɰ�ɫ��������Ϊ���������������������������ˡ�ϴ�ӡ����պõ�1.02g���弴Ϊ�������������������ʵ�����1.02g��102g/mol=0.01mol��������Ԫ���غ㣬�õ������ӵ����ʵ�����0.02mol��Ũ��Ϊ0.02mol��0.05L=0.4mol/L���۵ڶ��ݼ�����BaCl2��Һ�����ɰ�ɫ��������һ��������������ӣ��ޱ���������������������ϴ�ӡ�����õ�11.65g���弴���ᱵ��������11.65g�����ʵ���Ϊ11.65g��233g/mol=0.05mol������Ԫ���غ���������ӵ����ʵ�����0.05mol��Ũ��Ϊ0.05mol��0.05L=1mol/L�����Ͽ�֪��һ�����е������ǣ�NH4+��Al3+��SO42-����Ũ�ȷֱ��ǣ�0.4mol/L��0.4mol/L��1mol/L��һ������Fe3+��Mg2+��Ba2+��CO32-�����������������������0.02mol+0.02mol��3��0.08mol������������������0.1mol�����Ը��ݵ���غ��֪һ�����ڼ����������ʵ���������0.02mol������ȷ���Ƿ���������ӣ�A���������Ϸ�����֪��ʵ����в���������Ϊ���������ɵ�ԭ��Һ��c(NH4+)��0.4 mol��L��1��A����B���������Ϸ�����֪�����еİ�ɫ������һ����BaSO4������������ʵ�����0.05mol��B����ȷ��C���������Ϸ�����֪ԭ��Һ��һ����K������c(K��)��0.02mol��0.05L��0.4mol/L��C��ȷ��D�������Ϸ�����֪������ȷ�����������ӣ�D����ѡC��


 ������״Ԫ���Ծ�ϵ�д�
������״Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȡ��塢�������ϲ������Ҫԭ���ǣ� ��
A. ԭ�ӵĺ˵������������
B. ԭ������������
C. ԭ�Ӻ��������������������
D. ԭ�Ӻ�����Ӳ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ͼ�����һ�µ��ǣ� �� 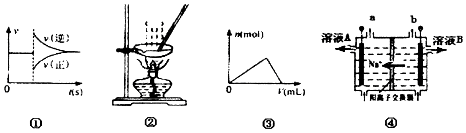
A.ͼ�ٿ��Ա�ʾ��ij��ѧƽ����ϵ�ı��¶Ⱥ�Ӧ������ʱ��ı仯
B.��ͼ2��ʾװ������FeCl3��Һ�Ʊ���ˮFeCl3
C.����ͼ�ۿ��Ա�ʾ��һ������������Һ�����ժ��һ��Ũ��������������Һʱ����Al��OH��3���������ʵ����仯
D.ͼ�ܵ�ⱥ��ʳ��ˮ��װ���У���ҺA��B����ˮ�������c��H+����A��B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.����ͬ�����£������������������������ֱ���ȫȼ�գ����߷ų�������
B.�ɡ�C��ʯī��=C�����ʯ������H=+119kJ?mol��1����֪�����ʯ��ʯī�ȶ�
C.��101KPaʱ��2g H2��ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��H2��g��+ ![]() O2��g��=H2O��l������H=+285.8 kJ?mol��1
O2��g��=H2O��l������H=+285.8 kJ?mol��1
D.��ϡ��Һ�У�H+��aq��+OH����aq��=H2O��l������H=��57.3l kJ?mol��1 �� ������0.5mol H2SO4��Ũ������l mol NaOH��Һ��ϣ��ų�����������57.31 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.���Ԫ����ͬ����Ԫ����������Ҳ��ͬ�IJ�ͬ��������ͬϵ��
B.����ʽ��ͬ�IJ�ͬ����һ����ͬ���칹��
C.��Է���������ͬ�IJ�ͬ����һ����ͬ���칹��
D.ͨʽ��ͬ�IJ�ͬ����һ������ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�е�Al3+������ȫ������ʵ��Լ���( )
A. NaOH��Һ B. ��ˮ C. Na2SO4��Һ D. NaCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڱ�״���£�CO��CO2������������Ϊ3.2g�����Ϊ2.24L��������CO��CO2����֮��Ϊ_______���������ӵ�����ΪNA��������Oԭ�ӵ���ĿΪ______��
��2����________mL 0.2 mol/L NaOH��Һ�к�1 g���ʣ�����480 mL 0.2 mol/L CuSO4��Һ����Ҫ����CuSO4��5H2O _________g��
��3��ȡ100 mLNa2CO3��Na2SO4�Ļ����Һ���������BaCl2��Һ��õ�29.02 g��ɫ�������ù���ϡ���ᴦ������������ٵ�9.32 g����������ų���ԭ�����Һ��Na2SO4�����ʵ���Ũ��Ϊ________mol��L��1�������������ڱ�״���µ����Ϊ________L��
��4����ʵ���ҽ�16.8g����NaHCO3����һ��ʱ����ʣ������������Ϊ13.7g������______ g NaHCO3���巢���˷ֽⷴӦ����������ʣ�������ȣ������ٲ����������ȴ��Ĺ����ܽ���ˮ�����1000mL����Һ�������Һ���ʵ����ʵ���Ũ����____________��
��5����1L AlCl3��FeCl3�����Һ�м��뺬a mol NaOH����Һʱ�������ij������ɴ����ֵ����������NaOH��Һ��������ʼ�ܽ⣬��ǰ������NaOH�����ﵽb molʱ���������ټ��٣���ԭ��Һ��Fe3+�����ʵ���Ũ��Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��19gij���۽������Ȼ���ACl2�к���0.4mol Cl- ���ӣ�ACl2��Ħ�������� _____________��A�����ԭ��������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ����������Ķ��ε�أ��乹��ʾ��ͼ���£�������Ӧ�Ļ�ѧ����ʽΪ��
Pb��s��+PbO2��s��+2H2SO4��aq�� ![]() 2PbSO4��s��+2H2O��l������˵������ȷ���ǣ� ��
2PbSO4��s��+2H2O��l������˵������ȷ���ǣ� ��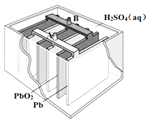
A.�ŵ�ʱ���������Һ��PHֵ����
B.�ŵ�ʱ����·��ת��0.2mol����ʱPb�缫��������20.7g
C.�ŵ�ʱ����Һ��H+��PbO2�缫�ƶ�
D.�ŵ�ʱ��������ӦΪ��PbO2��s��+4H+��aq��+SO42����aq��+2e���TPbSO4��s��+2H2O��l��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com