
| △c |
| △t |
| △c |
| △t |
| 15mol/L |
| 5min |
| 7 |
| 10 |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
| Q |
| 14 |
| Q |
| 14 |
| Q |
| 14 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
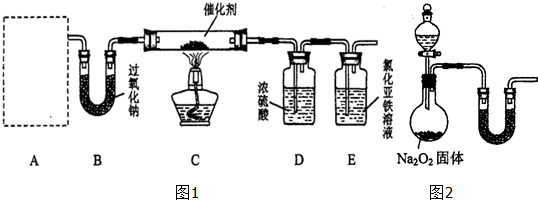
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应放出的热量为0.04a KJ |
| B、平衡时H2O的转化率为40% |
| C、若将容器的体积压缩为1L,有利于该反应平衡正向移动 |
| D、判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
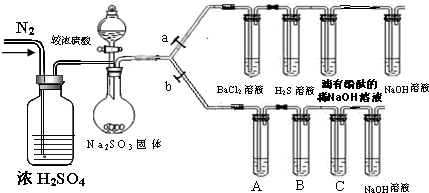
| 滴加的溶液 | 溴水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com