
【题目】相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c molL-1,密度为ρ gcm-3,则下列说法正确的是
A. 溶液密度ρ可表示为cMr/1000w
B. 物质的量浓度c可表示为ρV/(MrV+22.4m)
C. 溶液的质量分数w%可表示为:MrV/22.4m
D. 相对分子质量Mr可表示为:(22.4m×w%)/((1-w%)V)
【答案】D
【解析】
溶液的密度ρ=溶液质量/溶液体积,设溶液体积为VL,据此计算出溶液的密度;物质的量浓度c=nV,先计算出溶液体积、溶质的物质的量,再计算出溶液的浓度;根据溶质的质量分数=![]() ×100%进行计算;先计算出摩尔质量M=mn,根据水的质量、溶质的质量分数计算出溶液的质量及溶质的质量,再计算出该化合物的相对分子量。
×100%进行计算;先计算出摩尔质量M=mn,根据水的质量、溶质的质量分数计算出溶液的质量及溶质的质量,再计算出该化合物的相对分子量。
设溶液的体积为VL,则溶液中溶质的质量为:m=cVMr,VL该溶液的质量为:![]() ,溶液的密度ρ为
,溶液的密度ρ为![]() g/mL,A错误;溶液体积为
g/mL,A错误;溶液体积为![]() ml,溶质的物质的量为
ml,溶质的物质的量为![]() L,该溶液的浓度为
L,该溶液的浓度为![]() ,B错误;溶液中溶质的质量为
,B错误;溶液中溶质的质量为![]() ,溶液质量为
,溶液质量为![]() ,则溶质的质量分数为
,则溶质的质量分数为![]() ×100%,C错误;因质量分数为w%,水的质量为m,则溶液的质量为
×100%,C错误;因质量分数为w%,水的质量为m,则溶液的质量为![]() g,溶质的质量为
g,溶质的质量为![]() ,溶质的物质的量为
,溶质的物质的量为![]() L,则该化合物的摩尔质量,即相对分子质量Mr为
L,则该化合物的摩尔质量,即相对分子质量Mr为![]() ,D正确。
,D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】实验室可用下列几组试剂制取少量NH3:
①固体Ca(OH)2和NH4Cl;②浓氨水和固体CaO;③浓氨水。
请回答下列问题:
(1)用上述三组试剂制取少量NH3,需要加热的是________(填序号),第①组试剂中产生NH3的化学方程式可表示为____________________________________。
(2)下面的制取装置图中,方法①应选用装置________(填“A”或“B”,下同),方法②应选用装置________。

(3)在制取后,如果要干燥氨气,应选用的干燥剂是________(填字母)。
A.浓硫酸 B.固体氢氧化钠 C.五氧化二磷
D.碱石灰 E.固体CaO F.无水CaCl2
(4)检验集气瓶中是否收集满氨气的方法是__________________________________。
(5)为防止环境污染,如下装置(盛放的液体为水)可用于吸收多余NH3的是________(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(标准状况下,22.4LHCl气体溶于50mL水再配成250mL溶液,求:
(1)所得盐酸的物质的量浓度为_____?
(2)若将此溶液再稀释成1L溶液,则稀释后盐酸的物质的量浓度变为的多少_____?;配制该浓度的溶液需要的玻璃仪器_____?
(3)将(2)的溶液取出250mL与足量Zn反应可以产生的H2在标准状况下的体积为_____?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 从1L 1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B. 制成0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况)
C. 0.5L 2mol·L-1 BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D. 10g 98%硫酸(密度为1.84g·cm-3)与10mL 18.4mol·L-1硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.1mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个Cl2分子的质量为35.5g
D.标准状况下,1mol任何物质的体积均约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是
A. 澄清的石灰水与稀盐酸反应:OH—+H+ ![]() H2O
H2O
B. H2SO4与Ba(OH)2溶液反应:Ba2++2OH—+2H++SO42—![]() BaSO4↓+2H2O
BaSO4↓+2H2O
C. 盐酸滴在石灰石上:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D. 氢氧化铁与盐酸反应:Fe(OH)3+3H+![]() Fe3++3H2O
Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
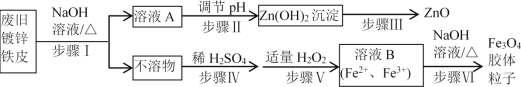
已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
(1)步骤Ⅰ用NaOH溶液处理废旧镀锌铁皮的作用有________。
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)步骤Ⅲ的实验操作是______________________。
(3)写出步骤Ⅳ反应的化学方程式_______________。写出步骤Ⅴ反应的离子方程式__________。
(4)Fe3O4胶体粒子能否用过滤法实现固液分离?____(填“能”或“不能”),理由是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Fe2+的核外电子排布式为_________________________________。
(2)元素的第三电离能I3:Fe______Mn(填“>”或:“<”)。
(3)H2O的沸点比H2S高的原因是_______________________________________。
(4)亚西尔阿拉法特的死因被怀疑是钋—210中毒。钋与氧同族,基态钋原子有________个未成对电子。钋沉积在铍(9Be)上用作原子弹的中子源。铍的氯化物BeCl2室温下为雪白色易升华的固体,能溶于水和部分有机溶剂。室温下BeCl2固体属于__________晶体,500-600°C时,氯化铍以二聚体的形式存在,其二聚体的结构式为__________________(配位键用“→”表示)。
(5)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
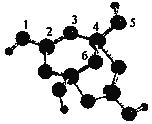
①在Xm-中,数字标号为4的硼原子的轨道杂化类型为___________;m=_______填数字)。
②若硼砂的式量为382 , 则其化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下刎有关实验装置、操作,不能实现相应实验目的的是

A. 装置甲可用酸性KMnO4溶液滴定FeSO4溶液
B. 用装置乙进行实验时若逐滴滴加AgNO3溶液先出现黄色沉淀,可说明 Ksp(AgCl)>Ksp(AgI)
C. 装置丙可用于收集氢气
D. 装置丁可用于 NaOH溶液除去溴苯中单质溴
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com