

·ÖĪö £Ø1£©×ĘÉÕ¹ĢĢåĪļÖŹŅ»°ćŹ¹ÓĆ£Ø“É£©ŪįŪö£»
£Ø2£©¹żĀĖÄÜÓĆÓŚÄŃČÜŠŌ¹ĢĢåŗĶŅŗĢåµÄ·ÖĄėŅŌ¼°µā·ÖĄėĮ½ÖÖ»„ČܵÄŅŗĢåÓĆÕōĮó£»
£Ø3£©¶žŃõ»ÆĆĢ¾ßÓŠ½ĻĒæµÄŃõ»ÆŠŌ£¬ŌŚĖįŠŌĢõ¼žĻĀÄÜŃõ»ÆµāĄė×ÓĪŖµāµ„ÖŹ£»
£Ø4£©ŻĶČ”µÄ»ł±¾ŌŌņĮ½ÖÖČܼĮ»„²»ĻąČÜ£¬ĒŅČÜÖŹŌŚŅ»ÖÖČܼĮÖŠµÄČܽā¶Č±ČŌŚĮķŅ»ÖÖ“óµÄ¶ą½ųŠŠ£»
£Ø5£©µāµ„ÖŹµÄĢŲŠŌĄ“¼ģŃéµāµ„ÖŹµÄ“ęŌŚ£®
½ā“š ½ā£ŗ£Ø1£©×ĘÉÕ¹ĢĢåĪļÖŹŅ»°ćŹ¹ÓĆ£Ø“É£©ŪįŪö£¬¶ųŪįŪö¼ÓČČŠčŅŖÓĆĹȿ½ÅÖ§³ÅČ»ŗó·ÅŌŚČż½Å¼ÜÉĻ£¬Čż½Å¼ÜĻĀĆęµÄæÕ¼ä·Å¾Ę¾«µĘ£®
¹Ź“š°øĪŖ£ŗBDE£»
£Ø2£©²½Öč¢ŪŹĒ·ÖĄė¹ĢĢåŗĶŅŗĢ壬ŌņŹµŃé²Ł×÷ĪŖ¹żĀĖ£¬²½Öč¢ŽµÄÄæµÄŹĒ“Óŗ¬µā±½ČÜŅŗÖŠ·ÖĄė³öµ„ÖŹµāŗĶ»ŲŹÕ±½£¬ŹĒĄūÓĆ»„ČܵÄĮ½ÖÖŅŗĢåµÄ·Šµć²»Ķ¬Ą“·ÖĄė£¬ŌņŹµŃé²Ł×÷ĪŖÕōĮó£¬
¹Ź“š°øĪŖ£ŗ¹żĀĖ£»ÕōĮó£»
£Ø3£©µāĄė×ÓŌŚĖįŠŌĢõ¼žĻĀæɱ»MnO2Ńõ»Æ£¬
¹Ź“š°øĪŖ£ŗ2I-+MnO2+4H+=Mn2++I2+2H2O£»
£Ø4£©øł¾ŻŻĶČ”µÄ»ł±¾ŌŌņĮ½ÖÖČܼĮ»„²»ĻąČÜ£¬ĒŅČÜÖŹŌŚŅ»ÖÖČܼĮÖŠµÄČܽā¶Č±ČŌŚĮķŅ»ÖÖ“óµÄ¶ą£¬
¹Ź“š°øĪŖ£ŗ±½ÓėĖ®»„²»ĻąČÜ£»µāŌŚ±½ÖŠµÄČܽā¶Č±ČŌŚĖ®ÖŠ“ó£»
£Ø5£©µāÓöµķ·Ū±äĄ¶É«£¬¼ģŃéĢįČ”µāŗóµÄĖ®ČÜŅŗÖŠŹĒ·ń»¹ŗ¬ÓŠµ„ÖŹµāµÄ¼ņµ„·½·Ø£ŗȔɣĮæĢįČ”µāŗóµÄĖ®ČÜŅŗÓŚŹŌ¹ÜÖŠ£¬¼ÓČė¼øµĪµķ·ŪŹŌŅŗ£»¹Ū²ģŹĒ·ń³öĻÖĄ¶É«£ØČē¹ū±äĄ¶£¬ĖµĆ÷»¹ÓŠµ„ÖŹµā£©£¬
¹Ź“š°øĪŖ£ŗȔɣĮæĢįČ”µāŗóµÄĖ®ČÜŅŗÓŚŹŌ¹ÜÖŠ£¬¼ÓČė¼øµĪµķ·ŪŹŌŅŗ£»¹Ū²ģŹĒ·ń³öĻÖĄ¶É«£ØČē¹ū±äĄ¶£¬ĖµĆ÷»¹ÓŠµ„ÖŹµā£©£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄ×ĘÉÕŅŌ¼°·ÖĄėŹµŃ飬ĢāÄæÄѶȏŹÖŠ£¬Ó¦øĆ×¢Ņā“ÓĶ¼±ķÖŠŃ°ÕŅĶ»ĘĘæŚ£¬ÕĘĪÕ»ł“”ŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®


 ÓĄĒ¬½ĢÓżŗ®¼Ł×÷ŅµæģĄÖ¼ŁĘŚŃÓ±ßČĖĆń³ö°ęÉēĻµĮŠ“š°ø
ÓĄĒ¬½ĢÓżŗ®¼Ł×÷ŅµæģĄÖ¼ŁĘŚŃÓ±ßČĖĆń³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
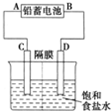 ČēĶ¼ŹĒŅŌĒ¦Šīµē³ŲĪŖµēŌ“£¬Ä£ÄāĀČ¼ī¹¤Ņµµē½ā±„ŗĶŹ³ŃĪĖ®µÄ×°ÖĆĶ¼£ØC”¢D¾łĪŖŹÆÄ«µē¼«£©£®
ČēĶ¼ŹĒŅŌĒ¦Šīµē³ŲĪŖµēŌ“£¬Ä£ÄāĀČ¼ī¹¤Ņµµē½ā±„ŗĶŹ³ŃĪĖ®µÄ×°ÖĆĶ¼£ØC”¢D¾łĪŖŹÆÄ«µē¼«£©£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | øÖ°åŹĒÕż¼«£¬Õż¼«ÉĻ·¢Éś»¹Ō·“Ó¦ | |
| B£® | ·ÅµēŹ±µē×ÓµÄĮ÷Ļņ£ŗÕż¼«”śµ¼Ļß”śøŗ¼« | |
| C£® | ·ÅµēŹ±OH-ĻņÕż¼«ŅĘ¶Æ | |
| D£® | ·ÅµēŹ±×Ü·“Ó¦ĪŖ£ŗ4Li+2H2O+O2=4LiOH |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŅČ© | B£® | ¼×Č© | C£® | ±ūČ© | D£® | ¶”Č© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
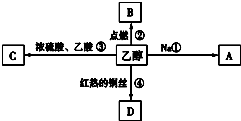 ŅŅ“¼ŹĒÉś»īÖŠ³£¼ūµÄÓŠ»śĪļ£¬ÄܽųŠŠČēĶ¼ĖłŹ¾µÄ¶ąÖÖ·“Ó¦£¬A”¢B”¢C”¢D¶¼ŹĒŗ¬Ģ¼µÄ»ÆŗĻĪļ£®
ŅŅ“¼ŹĒÉś»īÖŠ³£¼ūµÄÓŠ»śĪļ£¬ÄܽųŠŠČēĶ¼ĖłŹ¾µÄ¶ąÖÖ·“Ó¦£¬A”¢B”¢C”¢D¶¼ŹĒŗ¬Ģ¼µÄ»ÆŗĻĪļ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2KOH£Øaq£©+H2SO4£Øaq£©=K2SO4£Øaq£©+2H2O £Øl£©£»”÷H=-114.6kJ/mol | |
| B£® | KOH£Øs£©+$\frac{1}{2}$H2SO4£Øaq£©=$\frac{1}{2}$K2SO4£Øaq£©+H2O £Øl£©£»”÷H=-57.3 kJ/mol | |
| C£® | 2KOH£Øs£©+H2SO4£Øaq£©=K2SO4£Øaq£©+2H2O £Øl£©£»”÷H=-114.6 kJ/mol | |
| D£® | KOH£Øaq£©+$\frac{1}{2}$ H2SO4£Øaq£©=$\frac{1}{2}$K2SO4£Øaq£©+H2O £Øl£©£»”÷H=-57.3kJ/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ŠčŅŖ¼ÓČČ·½ÄÜ·¢ÉśµÄ·“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦ | |
| B£® | ·ÅČȵķ“Ó¦ŌŚ³£ĪĀĻĀŅ»¶ØŗÜČŻŅ×·¢Éś | |
| C£® | ·“Ó¦ŹĒ·ÅČČ»¹ŹĒĪüČȱŲŠėæ“·“Ó¦ĪļŗĶÉś³ÉĪļĖł¾ßÓŠ×ÜÄÜĮæµÄĻą¶Ō“óŠ” | |
| D£® | ĪüČČ·“Ó¦ŌŚŅ»¶ØµÄĢõ¼žĻĀŅ²ÄÜ·¢Éś |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µē½āĖ®£ŗ2H2O $\frac{Ķصē}{\;}$2H2”ü+O2”ü | |
| B£® | ½¹ĢæÓėĖ®ÕōĘų·“Ó¦£ŗC+H2O$\frac{\underline{\;øßĪĀ\;}}{\;}$H2+CO | |
| C£® | Ģ«Ńō¹ā·Ö½āĖ®£ŗ2H2O$\frac{TiO_{2}}{Ģ«Ńō¹ā}$2H2”ü+O2”ü | |
| D£® | ĢģČ»ĘųÓėĖ®ÕōĘų·“Ó¦£ŗCH4+H2O $\frac{øßĪĀ}{\;}$CO+3H2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com