
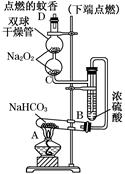
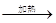 测定剩余固体质量
测定剩余固体质量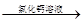 测定沉淀质量
测定沉淀质量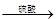 测定生成二氧化碳的质量
测定生成二氧化碳的质量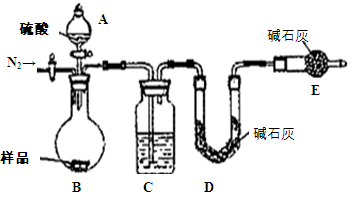
 或
或 (3分)
(3分) Na2CO3 + CO2↑+ H2O;(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解;
Na2CO3 + CO2↑+ H2O;(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解;

科目:高中化学 来源:不详 题型:填空题

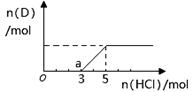
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.6% | B.2% | C.4% | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
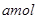 Na2O2和
Na2O2和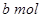 NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,
NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,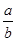 值可能为
值可能为| A.0.5 | B.0.65 | C.0.85 | D.1.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3的溶解度比同条件下的NaHCO3大 |
| B.Na2CO3、NaHCO3溶液都可与Ca(OH)2溶液反应,生成白色沉淀 |
| C.NaHCO3比Na2CO3稳定 |
| D.等物质的量的Na2CO3、NaHCO3与足量盐酸反应,消耗HCl的物质的量之比为2∶1,而放出气体的物质的量之比为1∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com