
| ĆܶČ/£Øg•cm-3£© | ČŪµć/”ę | ·Šµć/”ę | |
| ĖÄĀČ»ÆĪż | 2.2 | -33 | 114 |
| ½šŹōĪż | 5.77 | 231 |
·ÖĪö øł¾ŻĢāÖŠµÄ×°ÖĆŗĶŅ©Ę·æÉÖŖ£¬ÖʱøĖÄĀČ»ÆĪżŹĒÓĆøßĆĢĖį¼ŲŗĶÅØŃĪĖį·“Ó¦ÖĘĀČĘų£¬ÓƱ„ŗĶŹ³ŃĪĖ®³żČ„ĀČ»ÆĒā£¬ÓĆÅØĮņĖįøÉŌļ£¬µĆøÉŌļµÄĀČĘųÓėĪż·“Ӧɜ³ÉĖÄĀČ»ÆĪż£¬ÓĆĄäÄż¹ÜĄäČ“£¬ÓĆ׶ŠĪĘæ½ÓŹÜ£¬ĪŖ·ĄÖ¹æÕĘųÖŠĖ®·Ż½ųČė×°ÖĆĶ¬Ź±ĪüŹÕ¶ąÓąµÄĀČĘų£¬·ĄÖ¹ĪŪČ¾æÕĘų£¬ŌŚ×¶ŠĪĘæŗóĆęŌŁĮ¬Ņ»øö×°ÓŠ¼īŹÆ»ŅµÄøÉŌļ¹Ü£¬
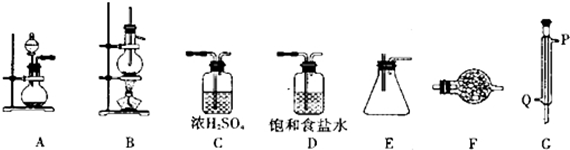
£Ø1£©°“ÕÕĘųĢåµÄ·¢Éś”¢³żŌÓ”¢øÉŌļ”¢Ī²ĘųĪüŹÕµČÉč¼ĘŹµŃéŅĒĘ÷µÄĮ¬½Ó£»
£Ø2£©GĪŖĄäÄż¹Ü£¬Ó¦“ÓQ½ųĖ®£¬“ÓP³öĖ®£»
£Ø3£©AÖŠÖʱøĀČĘų£¬ŌŚ²»¼ÓČȵÄĢõ¼žĻĀ½ųŠŠ£¬Ó¦ÓĆøßĆĢĖį¼ŲŗĶÅØŃĪĖįÖʱø£»
£Ø4£©FÖŠŹ¢×°¼īŹÆ»Ņ£¬¾ßÓŠ¼īŠŌ£¬æÉÓėĖ®»ņĖįŠŌĘųĢå·“Ó¦£»SnCl4Ė®½āÉś³ÉĒāŃõ»ÆĪżŗĶĀČ»ÆĒā£»
£Ø5£©øł¾Ż·½³ĢŹ½Sn+2Cl2=SnCl4æÉÖŖ£¬4.8gSnĶźČ«·“Ó¦ĄķĀŪÉĻÉś³ÉSnCl4µÄÖŹĮæĪŖ$\frac{261}{119}$=10.5g£¬SnCl4µÄ²śĀŹ=$\frac{Źµ¼Ź²śĮæ}{ĄķĀŪ²śĮæ}$”Į100%¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©ÓĆAÖʱøĀČĘų£¬·Ö±šŌŚD”¢CÖŠ½ųŠŠ³żŌÓŗĶøÉŌļ£¬Č»ŗóŌŚBÖŠ·¢Éś·“Ó¦ÖʱøSnCl4£¬ĄäČ“ŗóŌŚEÖŠŹÕ¼Æ£¬×īŗóĮ¬½ÓF£¬½ųŠŠĪ²ĘųĪüŹÕ£¬Į¬½ÓĖ³ŠņĪŖD”śC”śB”śG”śE”śF£¬
¹Ź“š°øĪŖ£ŗD”śC”śB”śG”śE”śF£»
£Ø2£©GĪŖĄäÄż¹Ü£¬ĪŖ“ļµ½³ä·ÖĄäÄżµÄŠ§¹ū£¬Ó¦“ÓQ½ųĖ®£¬“ÓP³öĖ®£¬
¹Ź“š°øĪŖ£ŗĄäÄż¹Ü£»Q£»
£Ø3£©AÖŠÖʱøĀČĘų£¬ŌŚ²»¼ÓČȵÄĢõ¼žĻĀ½ųŠŠ£¬Ó¦ÓĆøßĆĢĖį¼ŲŗĶÅØŃĪĖįÖʱø£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2MnO4-+16H++10Cl-=2Mn2++5Cl2”ü+8H2O£¬
¹Ź“š°øĪŖ£ŗ2MnO4-+16H++10Cl-=2Mn2++5Cl2”ü+8H2O£»
£Ø4£©FÖŠŹ¢×°¼īŹÆ»Ņ£¬¾ßÓŠ¼īŠŌ£¬æÉÓėĖ®»ņĖįŠŌĘųĢå·“Ó¦£¬·ĄÖ¹æÕĘųÖŠµÄĖ®·Ö½ųČė×°ÖĆEÖŠ£¬ĪüŹÕ¶ąÓąµÄCl2·ĄÖ¹ĪŪČ¾£¬SnCl4Ė®½āÉś³ÉĒāŃõ»ÆĪżŗĶĀČ»ÆĒā£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖSnCl4+4H2O=Sn£ØOH£©4+4HCl£¬
¹Ź“š°øĪŖ£ŗ¼īŹÆ»Ņ£»·ĄÖ¹æÕĘųÖŠµÄĖ®·Ö½ųČė×°ÖĆEÖŠ”¢ĪüŹÕ¶ąÓąµÄCl2·ĄÖ¹ĪŪČ¾£»SnCl4+4H2O=Sn£ØOH£©4+4HCl£»
£Ø5£©øł¾Ż·½³ĢŹ½Sn+2Cl2=SnCl4æÉÖŖ£¬4.8gSnĶźČ«·“Ó¦ĄķĀŪÉĻÉś³ÉSnCl4µÄĪŖ$\frac{261}{119}$=10.5g£¬SnCl4µÄ²śĀŹ=$\frac{Źµ¼Ź²śĮæ}{ĄķĀŪ²śĮæ}$”Į100%=$\frac{9.4g}{10.5g}$”Į100%=90%£¬
¹Ź“š°øĪŖ£ŗ90%£®
µćĘĄ ±¾Ģāæ¼²éÖʱøŹµŃé·½°øµÄÉč¼Ę£¬ĢāÄæÄѶČÖŠµČ£¬±¾Ģā×¢ŅāÖʱøĀČĘųµÄ·“Ó¦Ģõ¼ž£¬²»¼ÓČČŹ±ÓĆøßĆĢĖį¼ŲŗĶÅØŃĪĖį·“Ó¦£¬½ā“šŹ±×¢ŅāĢāÖŠŠÅĻ¢£»


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Cl2O7”¢P2O5”¢SO3”¢CO2”¢NO2¾łŹōÓŚĖįŠŌŃõ»ÆĪļ | |
| B£® | K2O”¢K2O2”¢KO2ĪŖĻąĶ¬ŌŖĖŲ×é³ÉµÄ½šŹōŃõ»ÆĪļ£¬¶¼ŹōÓŚ¼īŠŌŃõ»ÆĪļ | |
| C£® | øł¾ŻÄÜ·ń·¢Éś¶”“ļ¶ūŠ§Ó¦£¬æÉŅŌĒų·Ö½ŗĢåŗĶČÜŅŗ | |
| D£® | øł¾ŻČÜŅŗµ¼µēÄÜĮ¦ĒæČõ£¬½«µē½āÖŹ·ÖĪŖĒæµē½āÖŹ”¢Čõµē½āÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CH4£Øg£©+2O2£Øg£©ØTCO2£Øg£©+2H2O£Øl£©£»”÷H=+890.3 kJ•mol-1 | |
| B£® | CH4£Øg£©+2O2£Øg£©ØTCO2£Øg£©+2H2O£Øl£©£»”÷H=-890.3 kJ•mol-1 | |
| C£® | CH4£Øg£©+2O2£Øg£©ØTCO2£Øg£©+2H2O£Øg£©£»”÷H=-890.3 kJ | |
| D£® | 2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©£»”÷H=-285.8 kJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃé ±ąŗÅ | T/K | “߻ƼĮµÄ ÓĆĮæ/g | KMnO4ĖįŠŌČÜŅŗ µÄÅضČ/mol?L-1 | ŹµŃéÄæµÄ |
| ¢Ł | 298 | 0.5 | 0.01 | £Ø¢ń£©ŹµŃé¢ŁŗĶ¢ŚĢ½¾æKMnO4ĖįŠŌČÜŅŗµÄÅØ¶Č¶ŌøĆ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£» £Ø¢ņ£©ŹµŃé¢ŁŗĶ¢ŪĢ½¾æĪĀ¶Č¶ŌøĆ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£» £Ø¢ó£©ŹµŃé¢ŁŗĶ¢ÜĢ½¾æ“߻ƼĮ¶ŌøĆ·“Ó¦ĖŁĀŹµÄÓ°Ļģ |
| ¢Ś | ||||
| ¢Ū | ||||
| ¢Ü |
| KMnO4ĖįŠŌČÜŅŗµÄÅضČ/mol£®L-1 | ČÜŅŗĶŹÉ«ĖłŠčŹ±¼ät/min | ||
| µŚ1“Ī | µŚ2“Ī | µŚ3“Ī | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 18 g H2Oŗ¬ÓŠ3NAøöŌ×Ó | |
| B£® | 1 mol¼×±½ŗ¬ÓŠ6NAøöC-H¼ü | |
| C£® | ±ź×¼×“æöĻĀ£¬22.4 LĀČĖ®ŗ¬ÓŠNAøöCl2·Ö×Ó | |
| D£® | 2.8 gŅŅĻ©ŗĶ¶”Ļ©µÄ»ģŗĻĘųĢåÖŠĖłŗ¬Ō×ÓŹżĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com