
【题目】草酸亚铁(FeC2O4)可作为生产电池正极材料磷酸铁锂的原料,受热容易分解,为探究草酸亚铁的热分解产物,按下面所示装置进行实验。
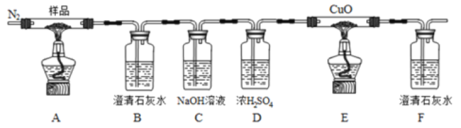
下列说法不正确的是
A.实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO
B.反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C.装置C的作用是除去混合气中的CO2
D.反应结束后,应熄灭A,E处酒精灯后,持续通入N2直至温度恢复至室温
【答案】B
【解析】
A选项,实验中观察到装置B中石灰水变浑浊,说明产生了分解产物中有CO2,E中固体变为红色,F中石灰水变浑浊,则证明分解产物中有CO,故A正确;
B选项,因为反应中生成有CO,CO会部分还原氧化铁得到铁,因此反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,不能证明分解产物中不含Fe2O3,故B错误;
C选项,为了避免CO2影响CO的检验,CO在E中还原氧化铜,生成的气体在F中变浑浊,因此在装置C要除去混合气中的CO2,故C正确;
D选项,反应结束后,应熄灭A,E处酒精灯后,持续通入N2直至温度恢复至室温避免生成的铜单质被氧化,故D正确;
综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】工业上以某软锰矿(主要成分为MnO2,还含有SiO2、Al2O3等杂质)为原料,利用烟道气中的SO2制备MnSO4·H2O的流程如下:
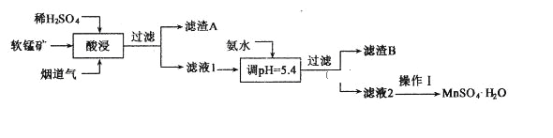
下列说法不正确的是
A. 滤渣A的主要成分能导电,可制备光导纤维
B. “酸浸”主要反应的离子方程式为MnO2+SO2=Mn2++SO42-
C. 加氨水调节pH的目的是除Al3+
D. 操作I为结晶、过滤、洗涤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
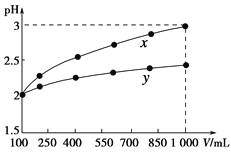
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)+3H2(g)![]() 2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确
2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确
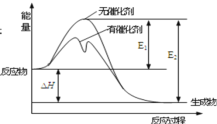
A.该反应正反应的活化能小于逆反应的活化能
B.该反应的逆反应为放热反应
C.使用催化剂使该反应的反应热发生改变
D.该反应的ΔH=E2-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10—10),下列说法正确的是
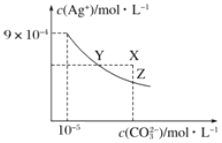
A.根据图示可计算出Ksp(Ag2CO3)=9×10—9
B.向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点
C.反应Ag2CO3(s)+2Cl—(aq)![]() 2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
D.将0.001mol/LAgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CO3的混合溶液,CO32—先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:

(1)①用离子方程式表示实验I溶液变红的原因___。
②针对实验I中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如图实验装置证实了猜想是成立的。

其中X溶液是___,检验产物SO42-的操作及现象是___。
(2)针对实验II“红色明显变浅”,实验小组提出预测。
原因①:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN-![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
原因②:SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-![]() [Fe(SCN)]2+平衡左移,红色明显变浅。
[Fe(SCN)]2+平衡左移,红色明显变浅。
已知:Mg2+与SCN-难络合,于是小组设计了如下实验:
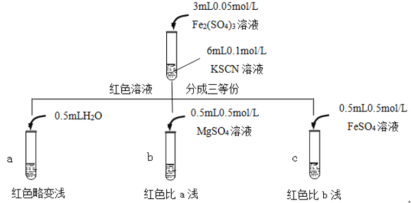
由此推测,实验II“红色明显变浅”的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.除去苯中的杂质苯酚可加入浓溴水后过滤
B.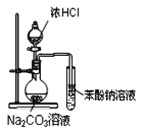 装置可证明酸性:盐酸>碳酸>苯酚
装置可证明酸性:盐酸>碳酸>苯酚
C.乙二酸与足量的酸性KMnO4溶液混合:5H2C2O4 + 2MnO4- + 6H+ =10CO2 ↑ + 2Mn2+ + 8H2O
D.鉴别![]() 和
和![]() 只能用金属钠
只能用金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法中正确的是
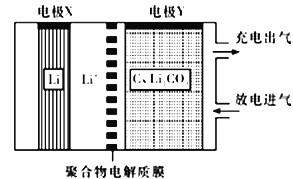
A. 该电池放电时,Li+向电极X方向移动
B. 该电池充电时,每转移0.4mol电子,理论上阳极产生4.48L.CO2
C. 该电池放电时,每转移4mol电子理论上生成1molC
D. 该电池充电时,阳极反应式为C+2Li2CO3-4e-==3CO2↑+4Li+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com