
【题目】下列有机物中,既能发生水解又能发生消去反应的是( )
A.乙醇B.一溴乙烷C.乙酸乙酯D.苯
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】某溶液含有①NO3- ②HCO3- ③SO32- ④CO32- ⑤SO42- 等五种阴离子,向其中加入少量的过氧化钠固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化)( )
A. ① B. ①⑤ C. ①④⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 该反应达到平衡后,保持容器休积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C. 830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻v正<v逆
D. 830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放显减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1L恒容中,硫可以发生如下较化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
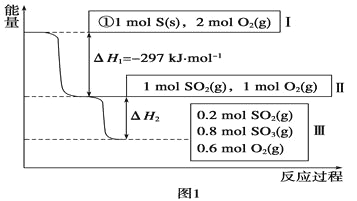
①写出能表示硫的燃烧热的热化学方程式:_________。,
②ΔH2=_________kJ·mol-1。
③在相同条件下,充入1molSO3和0.5mol的O2,则达到平衡时SO3的转化率为_______;此时该反应______(填“放出“或“吸收”)_______kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下40%~50%。
①CO2可转化成有机物实现碳循环。在休积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3min到9min,v(H2)=_______mol/(L·min)
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3min到9min,v(H2)=_______mol/(L·min)
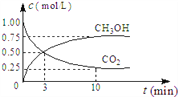
②为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有_______ (填编号)。
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO2和H2合成。参考合成反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数。下列说法正确的是______________。
CH3OH(g)的平衡常数。下列说法正确的是______________。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
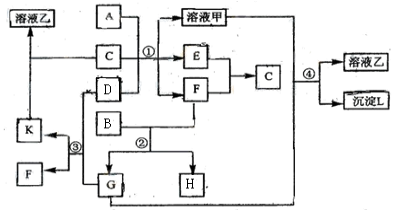
(1)A、B、C、D代表的物质分别为 、 、 、 (填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是 ;
![]() (3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
![]() (4)反应③产物中K的化学式为 ;
(4)反应③产物中K的化学式为 ;
![]() (5)反应④的离子方程式为 。
(5)反应④的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A.500 s内NO2的生成速率为2.96×10-3mol·L-1·s-1
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)﹤5.00mol/L
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com