
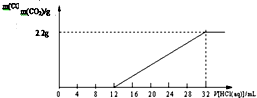
 ij̼��غ�̼����صĻ����Ʒ61.4g����ˮ�ܽ��ȡ������Һ��$\frac{1}{10}$�������л�������һ��Ũ�ȵ�ϡ���ᣬ��ͬʱ��¼�ų�CO2������������ϡ�����������õ���ͼ��ʾ�����ߣ�����˵������ȷ���ǣ�������
ij̼��غ�̼����صĻ����Ʒ61.4g����ˮ�ܽ��ȡ������Һ��$\frac{1}{10}$�������л�������һ��Ũ�ȵ�ϡ���ᣬ��ͬʱ��¼�ų�CO2������������ϡ�����������õ���ͼ��ʾ�����ߣ�����˵������ȷ���ǣ�������| A�� | �ù�����������Ӧ�Ļ�ѧ����ʽ��K2CO3+HCl�TKCl+KHNO3��KHNO3+HCl�TKCl+H2O+CO2�� | |
| B�� | �����Ʒ��̼Ԫ�ص���������Ϊ8.5% | |
| C�� | �����Ʒ�к�̼���41.4g | |
| D�� | ��ԭ���Һ���ּ��Ⱥ��ټ������������ᣬ���������в�����CO2�������� |
���� A����ͼ��֪����ʼû���������ɣ�������Ӧ��K2CO3+HCl=KCl+KHCO3������12mL����ʱ����ʼ���������ɣ���ʱ������Ӧ��KHCO3+HCl=KCl+H2O+CO2����
B��������32mL����ʱ�����ɵ���������ֵ������̼Ԫ���غ������Ʒ��̼Ԫ�ص���������������̼Ԫ������������
C����Һ��̼���ת��Ϊ̼����أ���������Ϊ12mL��KHCO3��HCl��Ӧ������������Ϊ32mL-12mL=20mL����Ӧ����1��1���У�����Ʒ��̼�����̼����ص����ʵ���֮��=12����20-12��=3��2������̼Ԫ���غ����̼��ص����ʵ���������������������
D������̼����ص����ʵ��������ݷ���ʽ2KHCO3$\frac{\underline{\;\;��\;\;}}{\;}$K2CO3+H2O+CO2�����ټ������������ᣬ̼��������ᷴӦ���ɶ�����̼���壮
��� �⣺A����ͼ��֪����ʼû���������ɣ�������Ӧ��K2CO3+HCl=KCl+KHCO3������12mL����ʱ����ʼ���������ɣ���ʱ������Ӧ��KHCO3+HCl=KCl+H2O+CO2������A��ȷ��
B��������32mL����ʱ�����ɵ���������ֵ������̼Ԫ���غ㣬��֪��Ʒ��̼Ԫ�ص�����=2.2g��$\frac{12}{44}$��10=6g������Ʒ��̼Ԫ����������=$\frac{6g}{61.4g}$��100%=9.77%����B����
C����Һ��̼���ת��Ϊ̼����أ���������Ϊ12mL��KHCO3��HCl��Ӧ������������Ϊ32mL-12mL=20mL����Ӧ����1��1���У�����Ʒ��̼�����̼����ص����ʵ���֮��=12����20-12��=3��2������̼Ԫ���غ��֪��̼��ص����ʵ���=$\frac{3}{5}$��$\frac{6g}{12g/mol}$=0.3mol������Ʒ��̼��ص�����=0.3mol��138g/mol=41.4g����C��ȷ��
D������̼����ص����ʵ��������ݷ���ʽ2KHCO3$\frac{\underline{\;\;��\;\;}}{\;}$K2CO3+H2O+CO2�����ټ������������ᣬ̼��������ᷴӦ���ɶ�����̼���壬���Լ�����̼ȫ��ת��Ϊ������̼���������ɶ�����̼��������ȣ���D��ȷ��
��ѡB��
���� �����Ի�ѧͼ����ʽ����������㣬����������������ȷ��̼�����̼����ص����ʵ�����ϵ�ǹؼ���ע�������غ�˼����н���Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������C��D�ֱ�Ϊ�κ�ˮ����÷�Ӧһ�����кͷ�Ӧ | |
| B�� | ��A��C�ǵ��ʣ�B��D�ǻ������÷�Ӧһ�����û���Ӧ | |
| C�� | ��A�ǿ����ԼB�ǿ������Σ���C��D�����������ֳ��� | |
| D�� | ��A�ǿ����ԼB�ǿ������Σ���C��Dһ������һ�ּ����һ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
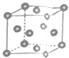
| A�� | ֻ�н�����ԭ�Ӳ������ֶѻ���ʽ | B�� | ���ֶѻ���ʽ�У���λ��Ϊ8 | ||
| C�� | ���ǽ��������һ�����ܶѻ���ʽ | D�� | ���ֶѻ���ʽ�Ŀռ������ʽϵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �������ռӦ | B�� | ��˿��������Ӧ | C�� | �����ƺ�ˮ��Ӧ | D�� | ̼��ƷֽⷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu+HNO3��Ũ����Cu��NO3��2 | |
| B�� | Cu+HNO3��ϡ����Cu��NO3��2 | |
| C�� | Cu$��_{��}^{����}$Cu$\stackrel{HNO_{3}}{��}$Cu��NO3��2 | |
| D�� | Cu $��_{��}^{Ũ����}$ CuSO4$\stackrel{Ba��NO_{3}��_{2}}{��}$Cu��NO3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
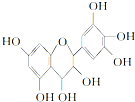
| A�� | �����ʼȿɿ������࣬Ҳ�ɿ������� | |
| B�� | 1 mol�����ʿ���4 mol Br2��Ӧ | |
| C�� | 1 mol�����ʿ���7 mol NaOH��Ӧ | |
| D�� | 1 mol�����ʿ���7 mol Na��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | +319.68kJ•mol-1 | B�� | +259.7kJ•mol-1 | C�� | -319.68kJ•mol-1 | D�� | -259.7kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ij�����ȼ����������ɫ���棬������һ����H2S | |
| B�� | ��ij����ͨ����ɫʯ���У���Һ��죬������һ����CO2 | |
| C�� | ��ij��Һ�м��������ữ���Ȼ�����Һ�����ɰ�ɫ��������Һ��һ������SO42- | |
| D�� | ��ij��Һ�м�������Ũ����������Һ���ȣ�����������ʹʪ���ɫʯ����ֽ��������Һ��һ������NH4+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com