

 4Al+3O2↑
4Al+3O2↑

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:不详 题型:单选题
| A.Al | B.Al(OH)3 | C.AlCl3 | D.Al2O3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiO2 | B.Al2O3 |
| C.MgO | D.CuO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 |
| C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接存放在铝制容器中 |
| D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将浓氨水缓慢滴入Al2(SO4)3溶液中,观察Al(OH)3沉淀的生成和溶解 |
| B.将Al(OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |
| C.将Al(OH)3沉淀转入蒸发皿中,加热至无水蒸气逸出,得氧化铝固体 |
| D.向Al(OH)3沉淀中分别加入稀硫酸和NaOH溶液探究Al(OH)3的两性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
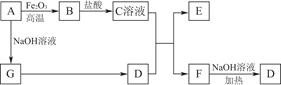
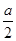 mol/L。
mol/L。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.此合金的熔点比镁和铝的熔点都高 |
| B.此合金能全部溶解于稀盐酸中 |
| C.此合金能全部溶解于氢氧化钠溶液中 |
| D.此合金的硬度比镁和铝的硬度都小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
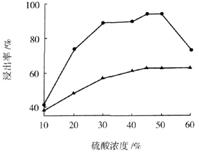
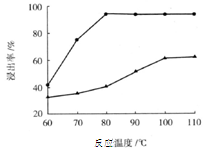
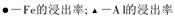
| 物质 | Ca(OH)2 | CaSO4 | Na2SO4 |
| 溶解度/g | 0.153 | 0.258 | 19.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com