
| 温度/°C | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
分析 (1)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ/mol;②N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,利用盖斯定律可求知反应热;
(2)氨气为碱性气体,易与酸反应,应用碱性电解质,负极发生氧化反应;
(3)①分析平衡常数随温度变化结合平衡移动原理判断;
②为了增大平衡时H2的转化率,平衡正向进行分析选项;
③依据浓度商和平衡常数比较得到反应进行的方向;
(4)①溶液中存在平衡NH3.H2O?NH4++OH-,根据溶液的pH值计算溶液中c(OH-),根据氯离子浓度计算c(NH4+),利用物料守恒计算溶液中c(NH3.H2O),代入NH3•H2O的电离常数表达式计算;
②a、滴加很少量氨水时,c(Cl-)>c(H+)>c(NH4+)>c(OH-);
b、盐酸稍稍过量时:c(Cl-)>c(NH4+)=c(H+)>c(OH-);
c、体系为NH4Cl溶液和NH3.H2O,氨水过量较多时,溶液呈碱性:c(NH4+)>c(OH-)>c(Cl-)>c(H+);
d、盐酸是1:1的电离氢离子,氢离子被氨水中和一部分,所以c(H+)不可能大于 c(Cl-).
解答 解:(1)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ/mol,
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
利用盖斯定律①-2×②可得:4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.8KJ/mol,
故答案为:4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.8KJ/mol;
(2)氨气为碱性气体,易与酸反应,所以电解质溶液应呈碱性,负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:碱性;2NH3-6e-+6OH-=N2+6H2O;
(3)①图表中平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应;
故答案为:随着温度的升高,平衡常数减小;
②反应是N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,反应是气体体积减小的放热反应,为了增大平衡时H2的转化率,平衡正向进行分析,
a.增大压强,平衡正向进行,氢气转化率增大,故a符合;
b.使用合适的催化剂,改变反应速率,不能改变平衡,氢气转化率不变,故b不符合;
c.升高温度平衡逆向进行,氢气转化率减小,故c不符合;
d.及时分离出产物中的NH3,平衡正向进行,氢气转化率增大,故d符合;
故答案为:ad;
③Qc=$\frac{{3}^{2}}{2×1}$=4.5>K=0.5,说明反应向逆反应方向进行,因此v正(N2)<v逆(N2),故答案为:<;
(4)①溶液中存在电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=$\frac{1}{2}$×0.1mol•L-1=0.05mol•L-1,故混合后溶液中c(NH3.H2O)=$\frac{1}{2}$×amol•L-1-0.05mol•L-1=(0.5a-0.05)mol/L,NH3•H2O的电离常数Kb=$\frac{1{0}^{-7}×0.05}{0.5a-0.05}$mol/L=$\frac{1{0}^{-8}}{a-0.1}$mol/L,
故答案为:$\frac{1{0}^{-8}}{a-0.1}$mol/L;
②a、滴加很少量氨水时,c(Cl-)>c(H+)>c(NH4+)>c(OH-),故a正确;
b、盐酸稍稍过量时:c(Cl-)>c(NH4+)=c(H+)>c(OH-)故b正确;
c、体系为NH4Cl溶液和NH3.H2O,氨水过量较多时,溶液呈碱性:c(NH4+)>c(OH-)>c(Cl-)>c(H+),故c正确;
d、盐酸是1:1的电离氢离子,氢离子被氨水中和一部分,所以c(H+)不可能大于 c(Cl-),故d错误;
故答案为:d.
点评 本题考查了反应热的计算、燃料电池电极反应式的书写、化学平衡问题、离子浓度大小的比较,综合性很强,明确溶液中的溶质是离子浓度大小比较的基础,注意结合电荷守恒来分析解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
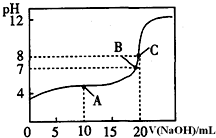 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大 | |
| B. | 将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的$\frac{1}{2}$ | |
| C. | 相同浓度的HCl和CH3COOH,两溶液中c(H+)相同 | |
| D. | 甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
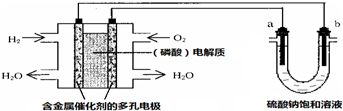
| A. | 电池工作时,正极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解时,当阴极逸出amol气体,同时有W克Na2SO4﹒10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是$\frac{71W}{161(W+36a)}$×100% | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 忽略能量损耗,当电池中消耗0.01g O2时,b 极周围会产生0.02g H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A. | 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 | |
| B. | 甲装置中阴极的反应为Fe-2e-═Fe2+ | |
| C. | 为了增加污水的导电能力,应向污水中如入适量的NaOH溶液 | |
| D. | 当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入足量酸性高锰酸钾溶液,若溶液紫红色褪去,则证明原溶液中有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com